Homéostasie du fer: régulation et aspects d’importance clinique
Le fer est un élément essentiel que nous devons absorber par la nourriture. Il est entre autres indispensable pour la synthèse de l’hémoglobine et la formation de clusters fer/soufre (pour le transport des électrons dans la mitochondrie et la production d’énergie).
Le fer peut aussi être toxique et se trouve rarement à l’état libre. C’est pourquoi tant le transport que le stockage du fer sont assurés par des protéines de transport et de stockage. 70% du fer de l’organisme est réparti entre l’hémoglobine et la myoglobine ainsi que les enzymes contenant du fer («fer fonctionnel») et 20% est du fer stocké (principalement sous forme de ferritine dans le foie). Seulement 0,2% circule librement dans le plasma, fixé sur la transferrine.
Résorption du fer dans l’intestin grêle
La résorption du fer s’effectue avant tout dans la muqueuse du duodénum. Après dénaturation par le suc gastrique, le fer de la nourriture est avant tout présent sous forme de complexes de fer trivalents (Fe3+). Une résorption est cependant uniquement possible sous la forme de fer divalent (Fe2+) – c’est pourquoi Fe3+ est transformé en Fe2+ par l’enzyme dCytB (cytochrome duodénal B). Ensuite, le transport actif à l’intérieur de la cellule est assuré par la protéine de transport DMT1 («divalent metal ion transporter-1»). Dans la cellule de la muqueuse, les ions de fer produisent un complexe avec l’apoferritine pour en donner la forme dépôt, la ferritine. La ferroportine (FPN) est la porte de sortie du Fe2+: c’est là que grâce à l'héphaestine et à la céruléoplasmine, l’oxydation en Fe3+ se produit. Ensuite, les ions de fer liés à la transferrine peuvent être transportés via la circulation sanguine et distribués aux cellules qui en ont besoin. [1]
Rôle de l’hepcidine dans le métabolisme du fer
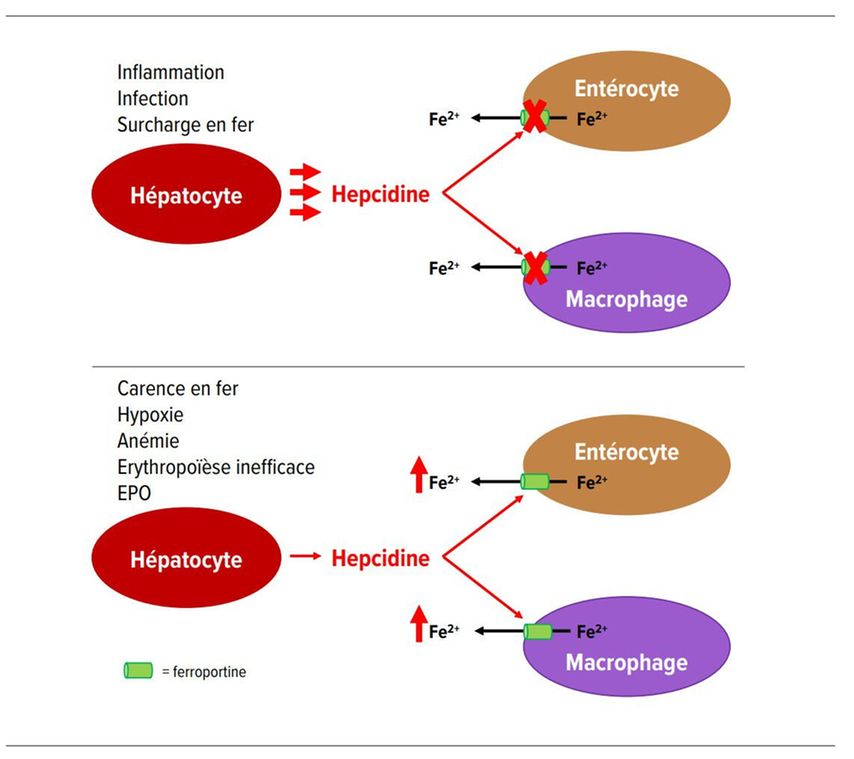
L’hepcidine est un peptide produit par les hépatocytes permettant de réguler la concentration de fer plasmatique. L’hepcidine se fixe et dégrade la ferroportine et ainsi bloque la porte de sortie du fer. L’hepcidine va ainsi inhiber le relargage du fer libéré physiologiquement dans le plasma après la phagocytose des érythrocytes sénescents par les macrophages (Fig. 1).
La synthèse de l’hepcidine est stimulée par une surcharge en fer ou des facteurs inflammatoires comme l’interleukine-6 et inhibée par la carence en fer ainsi que par l’ensemble des états qui stimulent l’érythropoïèse dans la moelle osseuse (p. ex. anémie, hémolyse, injections d’érythropoïétine).
Des altérations génétiques influençant la concentration sérique d’hepcidine peuvent entraîner une surcharge en fer et une hémochromatose, alors que dans l’anémie réfractaire au fer, les concentrations d’hepcidine sont augmentées. [2]
L’axe érythroferronehepcidine-fer
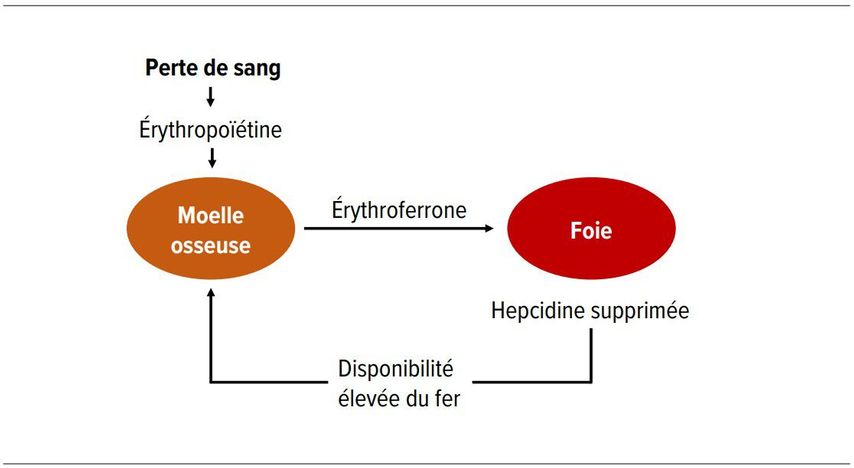
Une perte de sang provoque une érythropoïèse accrue réactive tout en supprimant la synthèse de l’hepcidine pour garantir une plus grande disponibilité du fer. Jusqu’à il y a quelques années, on connaissait mal la régulation de ce mécanisme. Le signal érythropoïétique qui en est responsable, à l’origine de cette corrélation, émane de l’érythroferrone (ErFe) – une hormone dont la synthèse est stimulée par l’érythropoïétine (EPO). L’EPO augmente donc l’érythropoïèse dans la moelle osseuse, d’une part, et favorise la formation d’érythroferrone d’autre part, l’érythroferrone empêchant à son tour la synthèse de l’hepcidine dans le foie. Cet «axe moelle osseuse-foie» régule donc l’équilibre entre l’érythropoïèse et la disponibilité du fer nécessaire (Fig. 2). [3]
Fig. 2: Axe moelle osseuse-foie du métabolisme du fer (d’après Martius et Krapf) [3]
Une perte de sang déclenche, via l’érythropoïétine, une augmentation de la synthèse
et de la sécrétion d’érythroferrone dans la moelle osseuse. Celle-ci supprime l’hepcidine dans le foie, ce qui entraîne une amélioration de la disponibilité du fer (absorption intestinale élevée et augmentation de la libération depuis les réserves internes)
Surcharge en fer d’origine génétique
Les maladies héréditaires provoquant une surcharge en fer peuvent s’accompagner ou non d’une anémie. Les thalassémies donnent lieu à une anémie, tandis que les hémochromatoses héréditaires ne provoquent pas d’anémie.
Surcharge en fer d’origine génétique sans anémie
Dans les hémochromatoses héréditaires (HH), des mutations des gènes de l’axe hepcidine-ferroportine entraînent un trouble de l’homéostasie du fer, ce qui induit une augmentation de l’absorption du fer et de la saturation de la transferrine, et finalement une toxicité accrue du fer non lié à la transferrine. [4] Chez les Caucasiens, la forme la plus fréquente d’HH est due à des mutations du gène HFE (HH de type 1). Les mutations avec perte de fonction des gènes HJV et HAMP (HH de type 2) ou TFR2 (HH de type 3) provoquent des maladies graves, également appelées hémochromatoses non liées au gène HFE. Dans les hémochromatoses de type 1–3 à transmission autosomique récessive, les taux d’hepcidine sont excessivement faibles par rapport à la surcharge en fer. Dans l’HH de type 4 à transmission autosomique dominante, il existe une mutation du gène SCLA0A1 qui conduit à une résistance à l’hepcidine. La maladie dite de la ferroportine fait aussi partie des HH de type 4 et conduit à une surcharge en fer dans les macrophages. La réalisation d’un test génétique permet de clarifier précocement la cause d’une surcharge en fer. [4]
Surcharge en fer d’origine génétique avec anémie
Les thalassémies font partie d’un groupe de maladies héréditaires induisant une surcharge en fer et une anémie. Ces maladies sont associées à un trouble partiel ou complet de la formation d’hémoglobine en raison d’un défaut de synthèse d’une ou de plusieurs chaînes de globine. La plupart de ces mutations sont transmises selon le mode autosomique récessif. En fonction du type de globine atteinte, on parle d’α-thalassémie ou de β-thalassémie. Par ailleurs, on distingue les formes hétérozygotes (thalassémie mineure) des formes homozygotes (thalassémie majeure). Les thalassémies s’accompagnent généralement d’une anémie microcytaire. [4]
Le groupe des anémies d’origine génétique avec surcharge en fer comprend également l’anémie sidéroblastique congénitale, l’anémie dysérythropoïétique congénitale ainsi que l’hypotransferrinémie et les mutations du gène DMT1 qui, comme les thalassémies, se caractérisent par une anémie microcytaire. [4]
Troubles acquis du métabolisme du fer
Surcharge en fer d’origine génétique avec anémie
Les maladies qui nécessitent des transfusions sanguines régulières provoquent une surcharge en fer. Un concentré érythrocytaire (CE) contient 200–250mg de fer. Le nombre de CE administrés chaque mois est en moyenne de deux unités lors d’un traitement transfusionnel modéré et de quatre unités env. lors d’un traitement transfusionnel intensif, ce qui correspond à une consommation annuelle respectivement de 24 et 48 CE. Les signes de surcharge en fer surviennent après l’administration de 10 à 20 unités. Cela signifie que les transfusions sanguines chroniques nécessitent un traitement chélateur concomitant. [4]
Le syndrome myélodysplasique avec sidéroblastes en couronne (SMD-RS) est une maladie clonale associée à des mutations somatiques. Il s’accompagne d’une anémie macrocytaire ainsi que d’une surcharge en fer. [4]
Carence martiale acquise
La carence en fer absolue se caractérise par une baisse de la saturation de la transferrine et un faible taux de ferritine, et provoque une anémie microcytaire. On la différencie de la carence martiale fonctionnelle dans laquelle le fer, quoique présent en quantité suffisante dans l’organisme, ne peut pas être assimilé. L’anémie observée dans les affections chroniques en est le parfait exemple. Lors d’affections inflammatoires chroniques et de processus malins, la formation d’hepcidine dans le foie augmente sous l’influence de cytokines proinflammatoires, ce qui bloque la ferroportine et retient le fer dans les entérocytes et les macrophages (voir Fig. 1). [1]
Réfléchissez:
Qu’est-ce qui stimule la synthèse de l’hepcidine et quelles en sont les conséquences?
La synthèse de l’hepcidine est stimulée par une surcharge en fer ou des facteurs inflammatoires libérés dans le cadre d’une inflammation ou d’une infection. L’hepcidine se fixe et dégrade la ferroportine et ainsi bloque la porte de sortie du fer et inhibe l’absorption intestinale du fer et la libération du fer (provenant de la dégradation de l’hémoglobine) par les macrophages.
Compte-rendu:
Mag. Dr méd. Anita Schreiberhuber
Journaliste médicale
Review:
Dr méd. Kaveh Samii, Service d’hématologie, Hôpitaux Universitaires de Genève
Source:
Iron Academy, 8 octobre 2020, Lausanne Intervention menée par le Dr méd. Kaveh Samii, Service d’hématologie, Hôpitaux Universitaires de Genève
Grossesse, postpartum et carence en fer
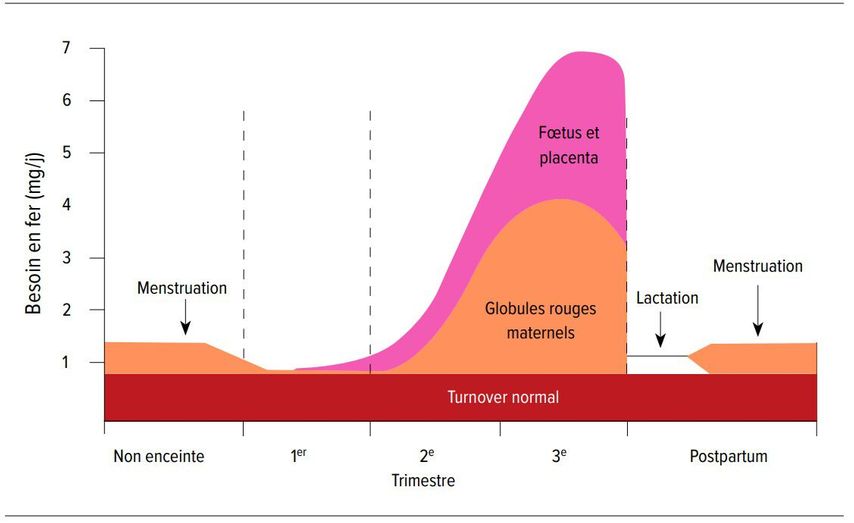
En Suisse, 32% des femmes enceintes présentent une carence martiale, 7% une anémie ferriprive et 33% une anémie en postpartum. [5] La vasodilatation et l’hémodilution entraînent une baisse physiologique de l’hémoglobine pendant la grossesse. Mais dans le même temps, la production d’érythrocytes et, par conséquent, les besoins en fer augmentent (Fig. 3).
Selon la définition de l’OMS, il y a anémie gestationnelle lorsque la valeur d’hémoglobine (Hb) est <110g/l. Compte tenu d’une baisse temporaire de la concentration d’Hb de 5g/l au cours de la grossesse, les CDC (Centers for Disease Control and Prevention) ont fixé le seuil de définition d’une anémie au deuxième trimestre à <105g/l. [5] L’OMS estime que 40% des femmes enceintes du monde entier développent une anémie. [6]
Afin de diagnostiquer suffisamment tôt une anémie gestationnelle, la Société suisse de Gynécologie et d’Obstétrique (SSGO) recommande de mesurer, chez toutes les femmes enceintes, au début de la grossesse, non seulement la valeur d’hémoglobine, mais également la ferritine sérique. Lorsqu’en plus d’une valeur d’Hb inférieure aux valeurs limites, la ferritine sérique est <30μg/l, les réserves de fer sont épuisées et il y a anémie ferriprive. Si l’Hb est inférieure à la valeur limite et la ferritine sérique est normale ou élevée, d’autres causes de l’anémie doivent être recherchées. Parmi les causes les plus fréquentes au cours de la grossesse, on trouve un déficit en vitamine B12 et/ou en acide folique, une maladie inflammatoire et des hémoglobinopathies. [5]
Fig. 3: Besoins quotidiens en fer estimés d’une femme de 55 kg pendant la grossesse (d’après Zhang XY, Pavord S: Chapter 3 - Iron deficiency in pregnancy. In: Pavord S, Hunt B: The obstetric hematology manual. 2nd edition. Cambridge University Press, 2018)
Effets de l’anémie sur la mère et le fœtus
L’anémie durant la grossesse constitue un facteur de risque important en termes de morbidité et de mortalité maternelle et fœtale.
Chez le fœtus, l’anémie maternelle entraîne un taux élevé de naissances prématurées, un retard de croissance intra-utérin, une influence défavorable sur le développement placentaire et une augmentation du risque de mort du fœtus in utero. [5, 7] Si la mère présente une anémie ferriprive, une diminution des réserves en fer néonatales peut être observée. [5]
Chez la future mère, l’anémie se manifeste par les symptômes caractéristiques, à savoir fatigue, vertiges orthostatiques, épuisement, performances physiques et mentales diminuées, céphalées, etc. Mais l’anémie est également associée à un risque accru d’infection, à une sollicitation cardiovasculaire plus importante, à des réserves sanguines diminuées au moment de l’accouchement, une durée d’hospitalisation prolongée, une production de lait réduite durant le postpartum et un risque accru de dépressions du postpartum, du stress et une altération de l’interaction mère-enfant. [5, 8–10]
Il a pu aussi être mis en évidence qu’une substitution de fer pendant la grossesse a un effet favorable durant la période du postpartum, diminue le risque de dépression et le stress et améliore l’interaction mère-enfant. [9, 10]
Traitement de l’anémie ferriprive durant la grossesse
En présence d’une anémie ferriprive avec une valeur d’Hb >90g/l, la SSGO recommande avant tout la substitution per os du fer (160–200mg/j). Une substitution par une dose de fer <100mg/j, comme le proposent certaines préparations multivitaminées, n’est pas suffisante. [5] La préparation ferrique doit être prise dans l’idéal le matin avant le repas et il faut renoncer à la prise concomitante d’antiacides, de préparations multivitaminées, de thé ou de café.
Un contrôle du succès du traitement est indiqué deux à quatre semaines après le début de la substitution. Après la normalisation de l’Hb, la substitution de fer doit être poursuivie pendant trois mois et pour une durée d’au moins six semaines après l’accouchement. Une mise systématique de toutes les femmes enceintes sous supplémentation ferrique n’est pas recommandée. [5]
Dans les situations suivantes, un traitement martial intraveineux (i.v.) est recommandé à partir du deuxième trimestre: [5]
Absence de réponse à l’administration de fer per os, (augmentation de l’Hb <10g/l en l’espace de 14 jours)
Intolérance aux préparations orales (effets secondaires gastro-intestinaux) ou compliance insuffisante
Anémie sévère ou avancée (Hb <90g/l)
Nécessité d’un traitement rapide et efficace de l’anémie (âge gestationnel avancé, placenta praevia, témoins de Jéhovah, etc.)
Le traitement de premier choix recommandé par la SSGO pour la substitution martiale i.v. est le carboxymaltose ferrique (Ferinject®). La préparation est administrée à une dose de 1000mg sous forme de perfusion courte de 15–30 minutes (maximum 20mg/kg de poids corporel). En guise d’alternative ou lorsque le carboxymaltose ferrique n’est pas disponible, l’administration de saccharose ferrique (Venofer®) est citée. [5]
Substitution martiale i.v
Le carboxymaltose ferrique a été analysé dans le cadre d’un vaste programme d’études. Dans toutes ces études, une efficacité supérieure aux substances comparables a été attestée. Aucunes réactions d’intolérance graves (p. ex. choc anaphylactique) n’ont été documentées dans ces études. [5]
Breymann et al. ont étudié le carboxymaltose ferrique par rapport à une prise de fer per os (sulfate de fer; FS) pendant 12 semaines dans une conception randomisée dans le traitement d’un total de 252 femmes enceintes. [11]
Les concentrations d’Hb se sont améliorées de façon comparable dans les deux groupes, cependant, sous carboxymaltose ferrique, une correction de l’anémie a été obtenue chez nettement plus de femmes que sous sulfate de fer (concentration d’Hb >110mg/l: 84 contre 70%; p=0,031). En outre, le carboxymaltose ferrique a entraîné, comparé au sulfate de fer, une amélioration significative de la vitalité (p=0,025). [11]
Des effets secondaires associés au traitement sont survenus chez 11 femmes dans le groupe carboxymaltose ferrique et chez 15 femmes dans le groupe sulfate de fer, sachant que sous sulfate de fer, nettement plus d’effets secondaires gastro-intestinaux Chez le fœtus, l’anémie maternelle entraîne un taux élevé de naissances prématurées, un retard de croissance intra-utérin, une influence défavorable sur le développement placentaire et une augmentation du risque de mort du fœtus in utero. 8 | www.med-diplom.ch Formation continue CME ont été rapportés que sous carboxymaltose ferrique (16 contre 3 cas). [11] Au total, le taux d’effets indésirables sous carboxymaltose ferrique est très faible. [5]
Anémie du postpartum
Un taux d’Hb <120g/l indique une anémie du postpartum, et une valeur <100g/l correspond à une anémie du postpartum cliniquement significative. L’Hb atteint le nadir environ 48h après l'accouchement. Si la femme a perdu plus de 500ml de sang pendant l’accouchement, est symptomatique ou a souffert d’une anémie prénatale, l’Hb doit être contrôlée à ce moment. La détermination de la ferritine n’est pas indiquée car, en tant que protéine de la phase aiguë, elle peut être faussement normale ou faussement élevée au cours des premières semaines suivant l’accouchement. [5]
L’anémie du postpartum doit également être traitée principalement par l’administration de fer par voie orale. Toutefois, en cas d’intolérance gastro-intestinale au traitement de fer oral ou d’anémie modérée à sévère (Hb <95g/l), la thérapie matriale intraveineuse est le premier choix. [5]
Compte-rendu:
Mag. Dr méd. Anita Schreiberhuber
Journaliste médicale
Review:
Dr méd. Nordine Ben Ali, Médecin adjoint, service de gynécologie et obstétrique, Hôpital fribourgeois, Fribourg
Source:
Iron Academy, 8 octobre 2020, Lausanne Intervention menée par le Dr méd. Nordine Ben Ali, Médecin adjoint, service de gynécologie et obstétrique, Hôpital fribourgeois, Fribourg
Gestion de la carence en fer chez l’enfant et l’adolescent: nouvelles recommandations suisses
La carence en fer est le déficit nutritionnel le plus répandu chez l’enfant et l’adolescent et peut se caractériser par des symptômes de l’anémie mais aussi tels que le retard de développement psychomoteur, la fatigue et la diminution des performances sportives et des résultats scolaires.
Le «Pediatric Hematology Working Group» du SPOG (Swiss Pediatric Oncology Group) a récemment élaboré des recommandations sur le diagnostic et la prise en charge de la carence en fer avec ou sans anémie chez l’enfant [12], lesquelles ont également été publiées en français [13]. Elles sont librement disponibles (en Allemand et Français) dans une forme résumée via le site internet du journal officiel de la Societé Suisse de Pédiatrie (link ci-dessous). Les recommandations y sont expliquées d’une manière applicable à la pratique quotidienne.
Chez les enfants, les symptômes de la carence en fer peuvent se recouper avec ceux de l’anémie, mais ce n’est pas nécessairement le cas: si un sujet souffre d’une carence en fer, il n’est pas nécessairement anémique, et vice versa. Il existe de surcroît des symptômes non spécifiques qui ne peuvent être attribués à aucun processus pathologique mais sont l’expression d’une croissance normale et de l’ajustement de l’enfant ou de l’adolescent à la vie active et moderne (p. ex. une fatigue par réduction de la qualité du sommeil à cause de l’exposition excessive aux écrans).
La carence en fer avec ou sans anémie peut se manifester par un éventail de symptômes très variés tels qu’une perte d’appétit, une fatigue, une perte de cheveux, des troubles du sommeil, etc. Les symptômes susceptibles d’évoquer une carence en fer doivent toujours être considérés et évalués dans le contexte des antécédents et/ou des résultats d’analyse supplémentaires. Le tableau clinique de la carence en fer dépend entre autres de l’âge, de la présence d’une anémie et de la gravité de celle-ci, des comorbidités et du moment où elle apparait. [13]
Étiologie et diagnostic
L’étiologie de la carence en fer chez l’enfant et l’adolescent varie en fonction de plusieurs facteurs, dont l’âge et le sexe, et est attribuable principalement à trois mécanismes: apports insuffisants, malabsorption (maladie cœliaque) et pertes sanguines (hémolyses, maladies gastrointestinales, infections parasitaires, pathologies rénales etc.). Chez le nouveau-né, la carence en fer peut aussi être due à une carence chez la mère. Chez l’enfant une anémie ferriprive est le plus souvent due à des apports alimentaires insuffisants. Chez l’adolescent, l’alimentation végétarienne/ végane est également une cause fréquente de carence en fer. Chez la jeune fille, il faut toujours penser à une ménorragie. [12, 13]
À l’heure actuelle, la détermination de la ferritine dans le sérum est le test le plus sensible et le plus spécifique pour diagnostiquer une carence en fer – la concentration est directement proportionnelle aux réserves de fer de l’organisme. Il faut toutefois ne pas oublier que la ferritine est également un marqueur d’inflammation, et son interprétation doit se faire en considérant l’état clinique de l’enfant.
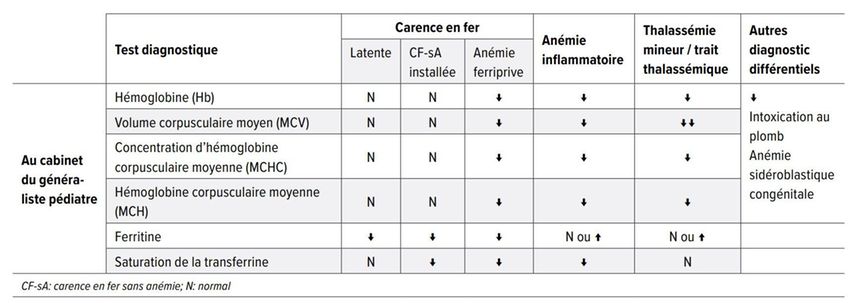
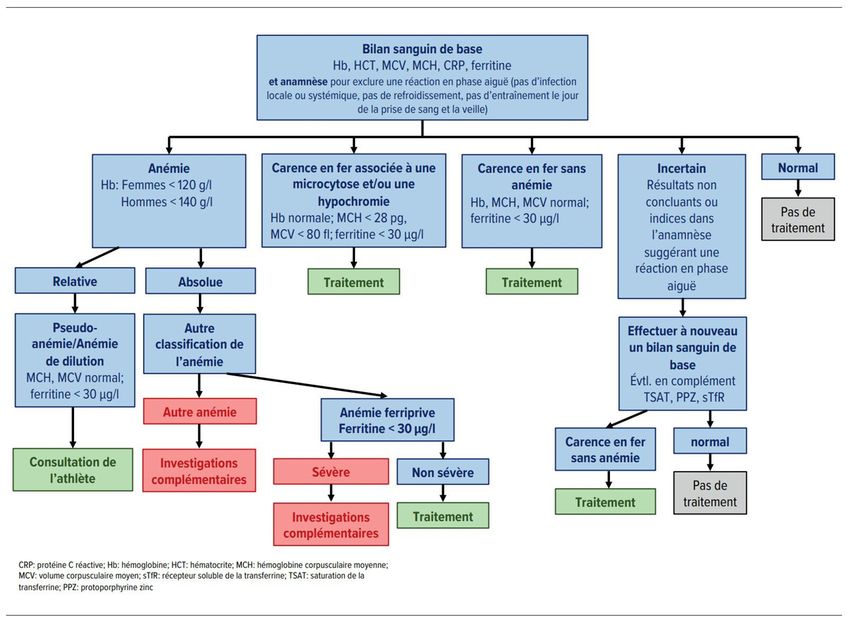
Le diagnostic différentiel de la carence en fer avec ou sans anémie comprend la détermination des taux d’hémoglobine et des paramètres associés (indexes érythrocytaires), des taux de réticulocytes, de la ferritine et de la saturation de la transferrine. Un bilan simple, qui peut être effectuer au cabinet du pédiatre, peut en général distinguer entre une anémie ferriprive et ses diagnostics différentiels (Tab. 1). [12, 13]
Tab. 1: Un bilan simple peut distinguer entre une anémie ferriprive et ses diagnostics différentiels (d’après Mattiello et al.) [13]
Effets du fer sur le développement neurocognitif de l’enfant
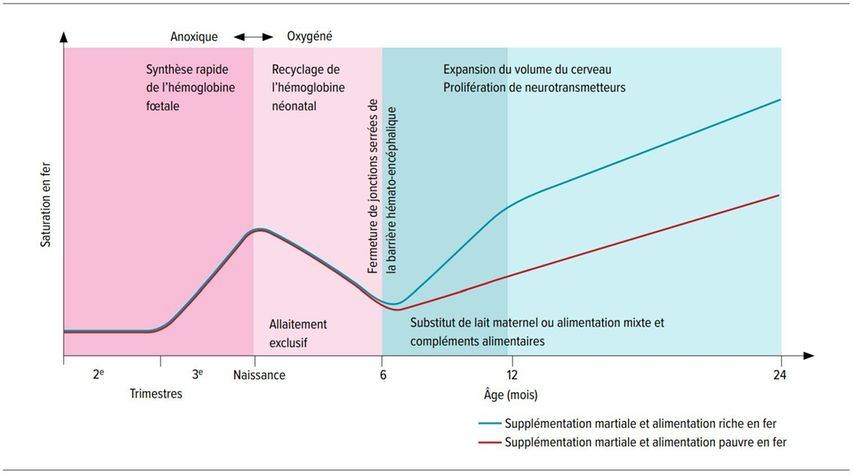
Le fer joue un rôle important pour le développement du système nerveux des enfants et des adolescents et sa carence a des effets négatifs. [12, 14] Dans le cerveau, le fer remplit plusieurs fonctions essentielles, notamment en tant que cofacteur enzymatique pour la synthèse des neurotransmetteurs et en tant qu’élément essentiel à la biosynthèse des gaines de myéline. [15] Pour l’évolution neurocognitive, il existe trois «fenêtres décisives»: on entend par ce terme des périodes au cours desquelles des facteurs comme la déficience nutritionnelle, l’exposition environnementale et le microbiome intestinal peuvent avoir une influence sur le développement du système nerveux. Ces fenêtres sont – selon le développement du fœtus ou du nourrisson/jeune enfant: la période pré-conceptionnelle et la période in utero, les six premiers mois de la vie et les 24 mois suivants (Fig. 4). [15]
D’un autre côté, en cas d’apport en fer excessif, il y a risque de surcharge en fer. L’administration non physiologique du fer par voie parentérale contourne l’absorption gastro-intestinale du fer et fait perdre le contrôle homéostatique de ce nutriment, et donc la protection physiologique contre un risque de surcharge en fer.
Par conséquent, l’apport en fer par voie entérale doit être privilégié, et cela idéalement par une alimentation saine et équilibrée. [14]
Fig. 4: Évolution des concentrations en fer chez le nourrisson et fenêtres critiques du développement du système nerveux (d’après Hare et al.) [15]
Les enfants allaités au sein pendant toute la période et de façon exclusive par des mères en bonne santé devraient avoir des concentrations de fer similaires, qui varient lorsque des régimes riches en fer (substitut de lait maternel ou alimentation solide complémentaire ou les deux; ligne bleue) ou pauvres en fer (ligne rouge) sont introduits
Effets d’une substitution martiale sur le développement psychomoteur
Aussi paradoxal que cela puisse sembler, chez les nourrissons et les enfants de moins de deux ans, la majorité des études ne montrent aucun bénéfice d’une supplémentation en fer en termes de développement cognitif, mais ce sujet reste controversé.
Chez les enfants en âge préscolaire (de deux à cinq ans), une légère amélioration du langage et de l’attention visuelle et sélective a été observée après la substitution martiale, mais seulement chez les enfants anémiques. [12, 13]
Chez les enfants de plus de 7 ans présentant une carence sévère en fer, des indices laissent à penser que la substitution martiale améliore la concentration et l’attention. Mais aucun effet sur la mémoire et le développement moteur n’a été retrouvé. [12, 13]
Chez les adolescents, la substitution martiale est efficace pour améliorer l’attention, la concentration et l’apprentissage linguistique, même en l’absence d’anémie. [12, 13]
Carence en fer et fatigue
Une carence en fer entraine une diminution de la production d’ATP, ce qui se traduit cliniquement par une fatigue voire une apathie. Des études montrent qu’une substitution martiale a un effet positif sur la fatigue chez les enfants et les adolescents, mais aussi chez les adultes. Ceci est particulièrement manifeste chez les adolescentes présentant des ménorragies avec une carence en fer secondaire, avec ou sans anémie. [12, 13]
Traitement
Chez les enfants une anémie ferriprive se traite le plus souvent avec une amélioration de l’alimentation. En ce qui concerne le traitement, le principe est le suivant: l’importance d’une nutrition riche en fer est irremplaçable par une substitution chez l’enfant. Le rôle du pédiatre est de conseiller la famille et fournir l’option la plus physiologique, la plus sécuritaire et la moins invasive pour la correction de la carence en fer chez l’enfant, en particulier à un jeune âge. L’éducation des familles et l’amélioration de leurs connaissances en matière de santé ne peuvent être remplacées par la substitution de fer oral sous forme d’un médicament, ou l’infusion intraveineuse non physiologique d’un nutriment essentiel, que l’on trouve couramment dans les aliments d’origine animale et/ou végétale. [16]
Lorsque le traitement d’une carence en fer avec ou sans anémie est indispensable, la substitution orale constitue la référence. [12, 13] Chez l’enfant, un traitement intraveineux (i.v.) est recommandé uniquement après consultation d’un spécialiste du fer pédiatrique et en deuxième ligne. [12, 13] Ce n’est que dans des cas exceptionnels, comme en cas de maladie inflammatoire chronique de l’intestin ou des maladies rénales, qu’un traitement martial intraveineux est proposé. [12, 13]
Réfléchissez:
Quel est le test le plus sensible et spécifique pour le diagnostic de la carence en fer chez l’enfant et l’adolescent?
La mesure de la ferritine sérique (FS) est actuellement considérée comme le test le plus sensible et spécifique pour le diagnostic de la carence en fer. L’interprétation des taux de FS s’avère néanmoins difficile en présence d’un état inflammatoire concomitant.
Compte-rendu:
Mag. Dr méd. Anita Schreiberhuber
Journaliste médicale
Review:
PD Dr méd. Raffaele Renella, Médecin adjoint et chef de l'unité de recherche, Unité d’hémato-oncologie pédiatrique, Service de pédiatrie, CHUV Centre hospitalier universitaire vaudois, Lausanne
Source:
Iron Academy, 8 octobre 2020, Lausanne Intervention menée par le PD Dr méd. Raffaele Renella, Médecin adjoint et chef de l'unité de recherche, Unité d’hématooncologie pédiatrique, Service de pédiatrie, CHUV Centre hospitalier universitaire vaudois, Lausanne
Links aux recommandations PHWG-SPOG sur le site de la Société Suisse de Pédiatrie:
Hengartner H et al.: Diagnostic et traitement de la carence en fer chez l’enfant avec ou sans anemie: resume et recommandations de consensus du groupe de travail hematologie pediatrique du SPOG. pédiatrie suisse:
https://www.paediatrieschweiz.ch/fr/diagnostic-et-traitement-de-la-carence-en-fer-chez-lenfant-avec-ou-sans-anemie-resume-et-recommandations-du-spog/
La carence en fer chez le sportif: quels conseils pour son patient?
Les médecins du sport sont fréquemment confrontés à la carence martiale et à l’anémie ferriprive chez l’athlète. Jusqu’à 52 % des jeunes athlètes féminines développent une carence martiale, et cette dernière survient plus fréquemment dans les sports d’endurance. [17]
Physiologie
Le fer absorbé est stocké dans le cytoplasme des entérocytes sous forme de ferritine et transporté, au moyen de la ferroportine, à la surface basolatérale des entérocytes. Lié à la transferrine, il est ensuite transporté jusqu’au foie, où la majeure partie du fer est stockée sous forme de ferritine et le reste est transporté jusqu’aux systèmes dépendants du fer comme la musculature ou la moelle osseuse. L’hepcidine synthétisée dans les hépatocytes est le régulateur majeur de l’homéostasie du fer et est responsable de l’exportation du fer des cellules de stockage. Lorsqu’il y a beaucoup de fer présent dans l’organisme et en réaction aux processus inflammatoires, la synthèse de l’hepcidine est accrue et donc le transport du fer dans la circulation est bloqué. Le même mécanisme empêche le transfert du fer des macrophages aux érythroblastes. [17]
Facteurs contribuant à la fatigue dans le sport
Toute forme d’entraînement provoque en quelque sorte une situation inflammatoire et comme ils font partie de la réaction en phase aiguë, plusieurs marqueurs du métabolisme du fer sont concernés par la cascade inflammatoire. Il a été démontré qu’un entraînement intensif entraîne une nette augmentation des concentrations d’hepcidine et que par conséquent, l’absorption du fer et le transfert du fer des macrophages aux érythroblastes sont bloqués. [17]
La carence en fer est l’une des causes médicales les plus courantes de la fatigue chez les athlètes. D’autres raisons médicales peuvent être des infections virales, le syndrome RED-S («relative energy deficiency in sport»), l’anémie d’autres causes, etc. Un athlète qui se plaint de fatigue devrait également être interrogé sur sa nutrition et, si nécessaire, des carences devraient être recherchées. Mais le surentraînement, une récupération insuffisante, la pression de la performance, le stress à l'école peuvent également provoquer chez les athlètes une fatigue et une incapacité à performer à leur niveau habituel. [18]
Thérapie de la carence martiale chez les sportifs
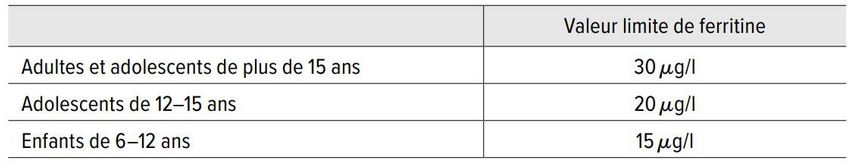
La Société suisse de médecine du sport recommande pour les athlètes adultes et les adolescents de plus de 15 ans une valeur limite de ferritine de 30μg/l et pour les adolescents de 12 à 15 ans une valeur limite de 20μg/l (Tab. 2). Une situation spéciale est constituée par l’entraînement en altitude chez les sportifs de compétition adultes. Étant donné que dans ces conditions, les besoins en fer sont accrus, une valeur de ferritine de 50μg/l devrait être visée avant l’entraînement en altitude.
Tab. 2: Valeur limite de ferritine recommandée par la Société suisse de médecine du sport pour les athlètes [17]
La première étape de la correction martiale consiste dans l’apport de fer par la nourriture. À noter que le fer hémique s’absorbe beaucoup mieux que le fer libre. Alors qu’on trouve dans la viande du fer hémique et du fer libre, une alimentation végétarienne ne contient que du fer libre. 14g de fer doivent être absorbés par jour avec la nourriture. En présence d’une carence martiale, le conseil nutritionnel doit généralement être associé à une thérapie martiale per os (40–60mg/j).
Une thérapie martiale i.v. devrait être envisagée lorsque le traitement par voie orale échoue ou qu’une correction immédiate du taux de fer est nécessaire. Le principal avantage d’une thérapie i.v. est la correction rapide de la carence martiale et la reconstitution des réserves de fer. [17]
Une méta-analyse sur la supplémentation en fer chez des athlète d’endurance avec une ferritine <35μg/l mais non anémiques a démontré que la supplémentation en fer améliore efficacement le niveau du fer et a un effet modéré sur l’Hb. [19] Mais la thérapie martiale n’augmente pas la performance de l’athlète, à moins que celui-ci soit carencé en fer.
Dans le cadre d’une autre étude, une supplémentation en fer par voie orale a été comparée à une supplémentation en fer par voie i.v. chez des athlètes d’endurance présentant un statut en fer diminué (ferritine <35μg/l et TSAT <20% ou ferritine <15μg/l) ou un statut en fer insuffisant (ferritine >15μg/l et TSAT >20%). [20] L’efficacité en termes de statut en fer, de masse d’hémoglobine (= Hb par érythrocyte) et de performance des athlètes a été évaluée. Autant la supplémentation en fer par voie orale que la supplémentation en fer par voie i.v. a induit une augmentation sensible du taux de ferritine; l’augmentation était toutefois plus importante à partir de la semaine 1 dans les deux groupes d’administration par voie i.v. que sous traitement oral.
Concernant l’Hb, une variation importante n’avait été observée dans aucun des groupes; la masse d’hémoglobine dans le groupe des athlètes présentant de faibles taux initiaux de fer et auxquels la supplémentation avait été administrée par voie i.v. avait toutefois augmenté de 4,9% (valeur médiane) en l’espace de six semaines. Cette augmentation était associée à un accroissement de la consommation maximale d’oxygène VO2max de 3% et à un allongement du temps de course jusqu’à l’épuisement.
Guidelines de la Société suisse de médecine du sport
Selon une déclaration de consensus de la Société suisse de médecine du sport, il est raisonnable de mesurer la ferritine 1 à 4 fois par an chez les athlètes. Si la valeur est inférieure à la limite (cf. Tab. 2), une supplémentation en fer (en premier lieu par voie orale) et une consultation nutritionnelle sont recommandées.
La Figure 5 représente un algorithme d’investigation diagnostique et fournit des indications pour un traitement chez les adultes. Lorsque le traitement par voie orale échoue ou qu’une correction rapide de la carence en fer est nécessaire, le fer peut être administré par voie i.v. Dans le cadre d’une thérapie martiale i.v. chez les sportifs d’élite, il faut également tenir compte des directives antidopage de la WADA selon lesquelles les injections i.v. ou les perfusions de >100ml de fer par unité de temps de 12 heures sont interdites à l’exception de celles qui sont administrées légitimement dans le cadre d’une hospitalisation ou d’un examen clinique dans un cadre d’urgence nécessaire. [17]
Fig. 5: Algorithme d’investigation diagnostique et indications pour une thérapie martiale chez les athlètes adultes (adapté d’après Clénin et al.) [17]
Compte-rendu:
Mag. Dr méd. Anita Schreiberhuber
Journaliste médicale
Review:
Dr méd. Boris Gojanovic, Centre de médecine du sport, Hôpital de La Tour, Meyrin
Source:
Iron Academy, 8 octobre 2020, Lausanne Intervention menée par le Dr méd. Boris Gojanovic, Centre de médecine du sport, Hôpital de La Tour, Meyrin
Préparation du patient à une opération élective
La détection en temps opportun et la prise en charge d’une anémie préopératoire sont extrêmement importantes étant donné que l’anémie en soi constitue un facteur de risque d’issue clinique défavorable. Elle s’accompagne d’une mortalité périopératoire accrue, d’une augmentation des complications postopératoires, d’une prolongation de l’hospitalisation et est à la fois l’un des principaux facteurs prédisposants à l’exigence de transfusions sanguines allogéniques périopératoires, ellesmêmes associées à une augmentation de la morbidité et de la mortalité postopératoires. [21]
Une prise en charge des patients structurée est essentielle
Les auteurs des lignes directrices des NATA (Network for Advancement of Transfusion Alternatives) ont identifié un créneau préopératoire de 28 jours au cours duquel, si la preuve d’une anémie est apportée, une thérapie est réalisable suffisamment tôt avant l’opération. [22] La cause de l’anémie devrait être évaluée, et des examens visant à constater la présence de carences nutritionnelles, d’une insuffisance rénale chronique et/ou d’une maladie inflammatoire chronique devraient être pratiqués. Si une carence nutritionnelle est attestée, elle doit être compensée. L’OMS indique comme valeurs cibles d’hémoglobine avant une opération ≥120g/l pour les femmes et ≥130g/l pour les hommes. [23]
L’idée très répandue selon laquelle une anémie préopératoire ne constitue aucun risque pour le patient et n’est pas une raison de reporter une opération élective, est fausse. En réalité, c’est le contraire: l’anémie préopératoire est un facteur de risque indépendant d’évolution défavorable et il est nécessaire d’y remédier avant l’intervention.
Le Patient Blood Management entraîne de meilleures issues
Depuis quelques années, dans un nombre croissant de centres, le Patient Blood Management (PBM) est introduit. Il repose sur trois piliers: 1) correction d’une anémie préopératoire, 2) réduction des pertes sanguines et 3) retenue lors des transfusions, et a pour objectif d’améliorer la survie des patients, de réduire les complications et la durée d’hospitalisation ainsi que les frais de santé.
Le fait que ces objectifs sont atteints avec le PBM a été prouvé, par exemple, dans une grande étude rétrospective réalisée en Australie. [24] Les résultats d’un total de 605046 patients ayant subi, après l’introduction du PBM, une opération entre 2008 et 2014, ont été analysés et comparés à des données datant de la période précédant l’introduction du PBM. Il s’est avéré qu’après l’introduction du PBM, nettement moins de concentrés d’érythrocytes (–41%), de plasma frais congelé (–47%) et de transfusions de plaquettes (–27%) ont dû être administrés et qu’en même temps, la mortalité à l’hôpital (odds-ratio [OR]: 0,79), la durée d’hospitalisation (ratio de taux d’incidence: 0,85) ainsi que les taux d’infections associées à l’hospitalisation (OR: 0,79) et d’infarctus du myocarde aigus resp. d’AVC (OR: 0,69) ont pu être diminués de manière significative (toutes valeurs p<0,001). [24] Au total, l’introduction du PBM a permis de tirer un bilan positif, se traduisant par des issues améliorées pour les patients, une réduction de l’utilisation de produits sanguins et des diminutions de coûts. [24]
Prise en charge de l’anémie préopératoire
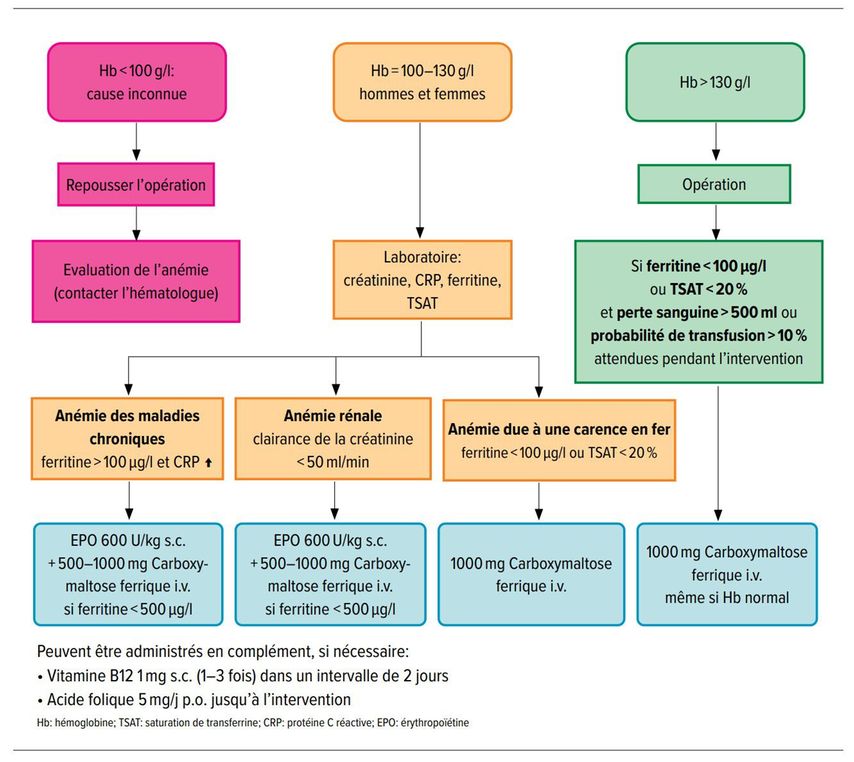
Dans le cas d’interventions électives, des examens diagnostiques doivent être effectués au moins quatre semaines avant l’opération pour déterminer si le patient présente une anémie, s’il faut s’attendre à des pertes sanguines ≥500ml et si la probabilité de l’exigence d’une transfusion est ≥10%. En présence d’une anémie, la façon de procéder dépend de la valeur de l’hémoglobine. La Figure 6 présente un algorithme en vue de la détection et de l’évaluation d’une anémie préopératoire et des recommandations concrètes pour son traitement. Si l’anémie ne peut être corrigée avant la date prévue pour l’opération, celle-ci doit être reportée.
Fig. 6: Algorithme de diagnostic et de traitement d’une anémie préopératoire (d’après Spahn et al.) [29]
Peters et al. ont mis en évidence, dans le cadre d’une méta-analyse de 32 études portant sur un traitement martial i.v. préopératoire, périopératoire et postopératoire pour traiter une anémie, les meilleures données probantes pour la thérapie martiale préopératoire. Cette dernière entraîne une augmentation sensible de l’Hb, une réduction des transfusions et un raccourcissement de la durée de l’hospitalisation. [25]
Réduction des pertes sanguines
Le deuxième pilier du PBM consiste à minimiser les pertes sanguines en adoptant des techniques opératoires adaptées et des mesures hémostatiques chirurgicales, mais aussi une prise en charge de la coagulation individualisée et ciblée. Cette manière de procéder permet également de réaliser des opérations majeures sans avoir recours à des transfusions sanguines allogéniques.
Usage restrictif des transfusions
Les transfusions sont-elles à la hauteur des espérances dont elles font l’objet – améliorent-elles effectivement les issues ou empêchent-elles à titre préventif des issues négatives? [26] Telle est la question abordée par Bruce D. Spiess, lequel a constaté qu’il n’y a guère, dans la littérature, d’articles prouvant une amélioration de l’état du patient du fait de la transfusion. Au contraire, les transfusions sont toujours associées à une immunosuppression, un risque d’infection, une insuffisance rénale, une défaillance d’organes multiples et le décès. [26] Quelle est donc la meilleure pratique en termes de transfusion?
En dépit de progrès effectués sur la base d’études cliniques de haut niveau qualitatif, il demeure quelques incertitudes en ce qui concerne l’identification et la mise en œuvre de la meilleure façon de procéder. Les données disponibles suggèrent cependant une tendance à des pratiques de transfusion restrictives. [27] Ainsi par exemple, l’initiative suisse «smarter medicine – Choosing Wisely Switzerland» retient, dans les listes Top 5 relatives aux transfusions: moins, c’est plus. [28]
Réfléchissez:
Pour quelles interventions électives est-il particulièrement important que le patient soit contrôlé à un stade précoce pour détecter une éventuelle anémie?
S’il faut s’attendre à des pertes sanguines ≥ 500 ml et si la probabilité de l’exigence d’une transfusion est ≥ 10 %, des examens diagnostiques doivent être effectués au moins quatre semaines avant l’opération pour déterminer si le patient présente une anémie.
Compte-rendu:
Mag. Dr méd. Anita Schreiberhuber
Journaliste médicale
Review:
Prof. Dr méd. Patrick Schoettker, Service d’anesthésie, CHUV Centre hospitalier universitaire vaudois, Lausanne
Source:
Iron Academy, 8 octobre 2020, Lausanne Intervention menée par le Prof. Dr méd. Patrick Schoettker, Service d’anesthésie, CHUV Centre hospitalier universitaire vaudois, Lausanne
Les dangers d’un excès de fer
La réserve corporelle de fer est de 3–5g, dont environ 3g de fer hémoglobinique et environ 0,4g de fer fonctionnel (myoglobine et enzymes contenant du fer). La quantité de fer stocké (ferritine, hémosidérine) est d’environ 1g chez les hommes et d’environ 0,5g chez les femmes préménopausées. Seule une petite partie du fer (4mg) est liée à la transferrine dans la circulation. Avec la nourriture, quelque 10–20mg de fer sont absorbés, dont environ 10% sont résorbés. La perte martiale physiologique quotidienne est de 1mg, chez les femmes en phase de menstruation d’environ 2mg/d. [30]
Toxicité du fer
En cas de surcharge martiale et si la réserve de fer corporelle >10g, la capacité des réserves de fer est dépassée et le fer s’accumule, en particulier dans le foie, le cœur, le pancréas et les organes endocriniens.
Cette accumulation de fer a un effet toxique sur les organes concernés, ce qui entraîne, au niveau du foie, une cirrhose, au niveau du cœur d’une part une insuffisance cardiaque et d’autre part des arythmies et, dans le domaine endocrinien, avant tout un diabète. La surcharge martiale a cependant aussi un effet désastreux en termes de mortalité. Dans une analyse rétrospective menée auprès de patients atteints d’anémie falciforme qui avaient régulièrement besoin de transfusions sanguines, la mortalité au cours de la période d’observation de 12 ans était de 64% chez les patients présentant une surcharge martiale contre 5% chez les patients sans surcharge martiale. [31]
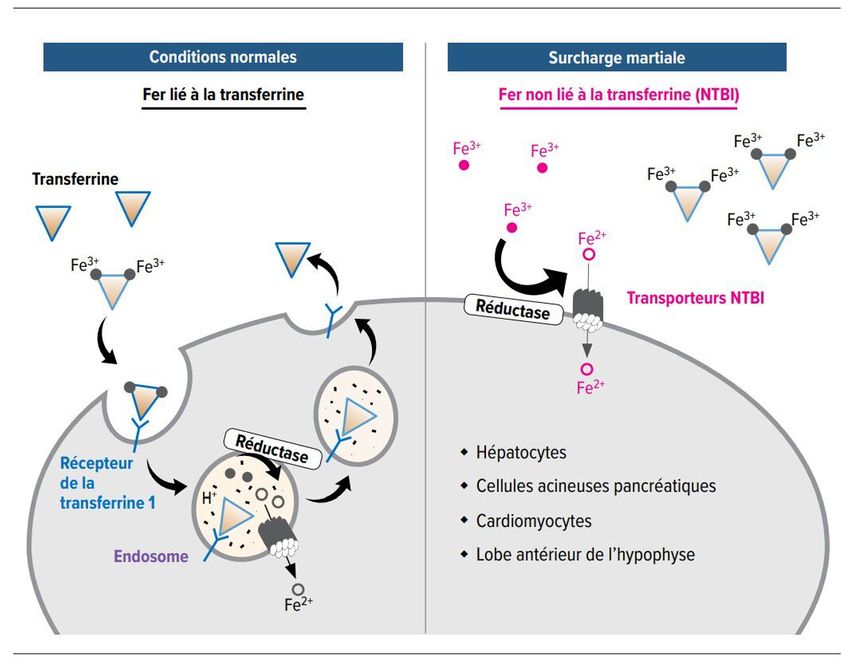
Le deuxième problème de la surcharge martiale consiste dans le fait que la capacité de liaison de la transferrine est dépassée et que par conséquent, du fer libre («non-transferrin bound iron», NTBI) est alors présent dans le sérum et les cellules. Le NTBI est une forme de fer redox-active et potentiellement toxique qui entraîne la formation de radicaux libres dans les organes affectés, avec pour conséquence des dommages aux organes, dont certains sont irréversibles (Fig. 7). [32]
Fig. 7: En conditions physiologiques, le fer dans la circulation est toujours lié à la transferrine, en cas de surcharge martiale, la capacité de liaison de la transferrine est dépassée, de sorte que désormais du fer libre circule et pénètre dans les cellules (adapté d’après Knutson et al.) [32]
Au laboratoire, une surcharge martiale ne peut être prouvée que par la mesure supplémentaire de la saturation de la transferrine (TSAT), la seule mesure de la ferritine ne la reflète pas.
Les causes connues de surcharge en fer sont l’hémochromatose et les maladies qui nécessitent des transfusions sanguines régulières, telles que la thalassémie majeure et les syndromes myélodysplasiques.
Hémochromatoses héréditaires
L’hémochromatose héréditaire est l’une des maladies héréditaires les plus fréquentes. Elle s’accompagne d’une surcharge martiale et de dépôts de fer dans différents organes, en particulier dans le foie, du fait d’une absorption intestinale accrue de fer. [33, 34]
La forme la plus fréquente d’hémochromatose héréditaire est due à une mutation du gène HFE (le plus souvent C282Y). Elle se transmet selon le mode autosomique récessif et représente environ 90% des hémochromatoses héréditaires. Dans la population caucasienne, environ 0,5% des individus sont des porteurs homozygotes de l’allèle C282Y. Comme la pénétrance clinique est faible, même en cas de mutation homozygote C282Y du gène HFE, une partie des sujets atteints reste en bonne santé. [33, 34] Chez les hommes, la maladie se déclare le plus souvent entre 30 et 50 ans et chez les femmes, seulement à partir de 50 ans à cause de la perte de sang régulière au cours des menstruations. Si la maladie est diagnostiquée et traitée avant la survenue d’une cirrhose ou d’un diabète, les personnes atteintes ont une espérance de vie normale. [34]
Tableau clinique
Le tableau clinique de l’hémochromatose héréditaire est souvent non spécifique et les symptômes peuvent être très variés. La maladie ne se manifeste généralement que par un faible nombre de symptômes, voire même par un seul symptôme. [34] Une hémochromatose héréditaire peut être suspectée en présence de signes cliniques ou devant la découverte d’anomalies des marqueurs du fer.
L’un des premiers symptômes est une fatigue permanente. Les signes et symptômes fréquents sont aussi une faiblesse, des vertiges, des douleurs épigastriques, une hyperpigmentation, notamment des zones exposées, ainsi que des arthralgies, notamment au niveau des deuxième et troisième articulations métacarpophalangiennes et ultérieurement du poignet et d’autres articulations. Les complications plus rares sont un diabète et d’autres troubles liés aux dépôts de fer, au niveau des organes endocriniens.
Le dépôt excessif de fer dans le foie entraîne le développement d’une fibrose et par la suite d’une cirrhose associée à un risque accru de cancer hépatocellulaire. Au niveau du cœur, les dépôts de fer peuvent provoquer une cardiopathie pouvant se traduire par des troubles du rythme et être à l’origine d’une insuffisance cardiaque. [33, 34]
Diagnostic
La mesure de la saturation de la transferrine est le meilleur test pour orienter le diagnostic et dépister précocement une hémochromatose. Un taux >60% chez l’homme et >50% chez la femme est un marqueur assez sensible d’une hémochromatose. Le taux de ferritine fournit des informations sur la réserve de fer ainsi que sur la sévérité de la maladie et des dépôts de fer. Une élévation des transaminases peut être un signe d’hépatopathie. La réalisation d’un test génétique est l’étape suivante pour confirmer le diagnostic d’hémochromatose héréditaire. Une biopsie hépatique visant à déterminer le score de fibrose est recommandée à partir d’un taux de ferritine ≥1000μg/l. En présence de taux de ferritine plus faibles, l’IRM hépatique est généralement suffisante pour quantifier la surcharge martiale. [33, 34]
Traitement
Le traitement de l’hémochromatose héréditaire consiste en des saignées régulières qui doivent être pratiquées au début toutes les semaines ou toutes les deux semaines. L’objectif est de réduire la saturation de la transferrine en dessous de 40%. En présence d’une hyperferritinémie, il est important de baisser rapidement le taux de ferritine en dessous de 1000μg/l. [33]
Fer, syndrome métabolique et diabète
Ces dernières années, il est apparu qu’il y a également un rapport entre les concentrations de ferritine fortement accrues et le syndrome métabolique. Dans la population générale, l’hyperferritinémie dysmétabolique est actuellement également la cause la plus fréquente d’augmentation des concentrations de ferritine. [35]
Le rapport entre le fer, le syndrome métabolique et le diabète a également été analysé dans l’étude CoLaus basée sur la population avec près de 6000 participants. [35] Il s’est avéré que les volontaires ayant un syndrome métabolique présentaient une valeur de ferritine moyenne significativement plus élevée que ceux sans syndrome métabolique (femmes: ≈150μg/l contre ≈100μg/l; hommes: ≈320μg/l contre ≈250μg/l; p<0,001). Parallèlement, la prévalence de l’hyperferritinémie (>300μg/l) chez les volontaires avec un syndrome métabolique était significativement plus élevée que chez ceux sans cette perturbation (femmes: 11,4% contre 2,2%; hommes: 40,6% contre 25%). Pour les volontaires avec resp. sans diabète, le tableau est quasi identique. [35]
Il est intéressant de noter que l’hyperferritinémie dysmétabolique n’était pas associée à une surcharge martiale, ce qui amène les auteurs à supposer que les taux élevés de ferritine sont des signes d’inflammation à bas seuil et sont associés à un risque accru de développer un diabète. [35] En fin de compte, cependant, on ne sait toujours pas si les taux élevés de ferritine sont la conséquence du syndrome métabolique ou, inversement, le facteur à l’origine de l’insulinorésistance.
Compte-rendu:
Mag. Dr méd. Anita Schreiberhuber
Journaliste médicale
Review:
Dr méd. Jean-François Lambert, Médecin agréé en hématologie, Hôpital de Nyon
Source:
Iron Academy, 8 octobre 2020, Lausanne Intervention menée par le Dr méd. Jean-François Lambert, Médecin agréé en hématologie, Hôpital de Nyon
Prise en charge de l’insuffisance cardiaque
L’insuffisance cardiaque est un syndrome clinique défini par des symptômes et des signes et causée par une anomalie structurelle ou fonctionnelle myocardique.
Il existe plusieurs types de classification de l’insuffisance cardiaque:
Selon la fraction d’éjection ventriculaire gauche (FEVG)
Insuffisance cardiaque à FEVG préservée (HFpEF): FEVG ≥50%
Insuffisance cardiaque avec FEVG modérément diminuée: (HFmrEF): FEVG =40–49%
Insuffisance cardiaque avec FEVG réduite (HFrEF): FEVG <40%
Selon la présentation et l’évolution de la maladie
Insuffisance cardiaque aiguë
Insuffisance cardiaque chronique compensée
Insuffiance cardiaque chronique décompensée
Selon la sévérité des symptômes et de la limitation de l’activité physique
Classification NYHA (New York Heart Association): classe I–IV (Tab. 3)
Tab. 3: La classification NYHA pour définir l’insuffisance cardiaque repose sur la sévérité des symptômes et leur survenue lors de l’activité physique
Traitement – atteindre la dose cible est important
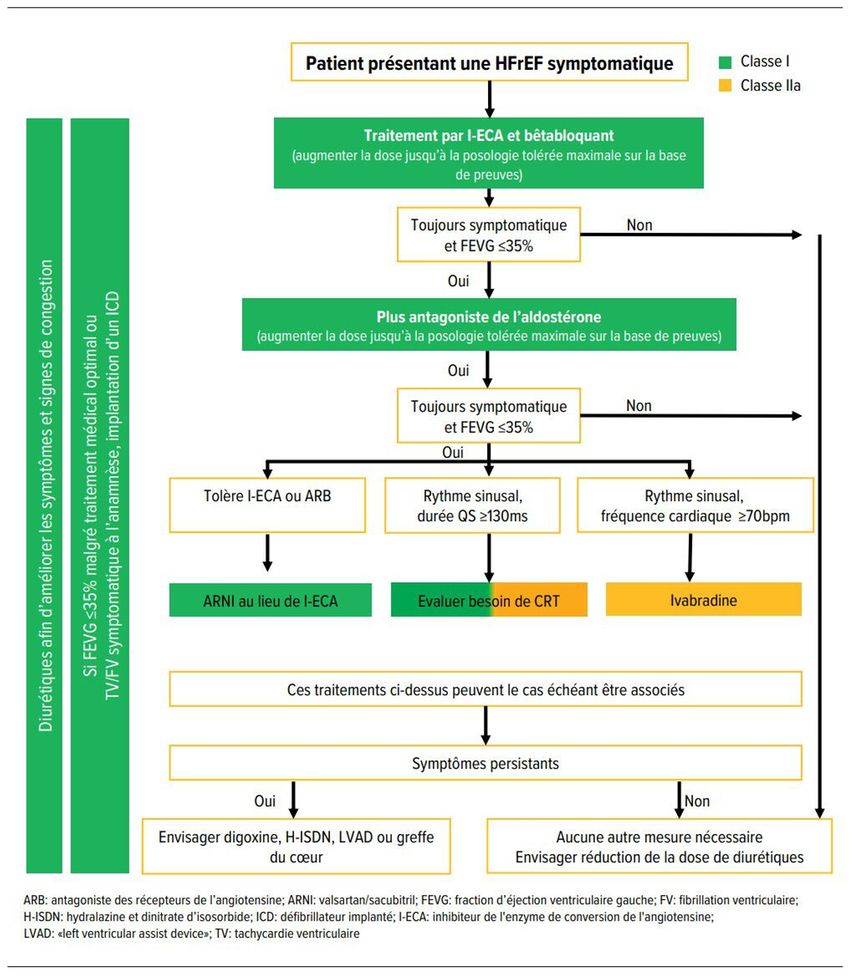
Le traitement médicamenteux de l’HFrEF obéit à un plan par étapes et comprend des diurétiques (traitement symptomatique), des inhibiteurs de l’enzyme de conversion (I-ECA) ou des sartans, des bêta-bloquants, des antagonistes des récepteurs de l’aldostérone (ARB). Selon la situation clinque, on peut remplacer l’I-ECA ou le sartan par le valsartan/sacubitril (inhibiteur de la néprilysine) (classe dénommée ARNI). [36] La Figure 8 présente l’algorithme de traitement proposé par la Société européenne de cardiologie (ESC). [36] Il est important d’adapter et d’augmenter jusqu’aux doses recommandées dans les recommandations. Une étude de registre de grande envergure montre que ce n’est souvent pas le cas dans la réalité: dans la cohorte étudiée, <20% des patients ont reçu les médicaments à la dose cible recommandée. [37]
Fig. 8: Procédure pour les patients atteints d’insuffisance cardiaque à fraction d’éjection réduite (d’après Ponikowski et al.) [36]
Substitution martiale chez les patients atteints d’insuffisance cardiaque chronique
Les patients avec une insuffisance cardiaque doivent bénéficier d’un bilan à la recherche de comorbidités. L’une des comorbidités fréquentes est la carence martiale, que l’on observe chez jusqu’à 50% des patients atteints d’insuffisance cardiaque chronique. Le dosage de la ferritine et de la saturation de la transferrine (TSAT) sont recommandés (classe de preuves I, niveau de recommandation C). [36] Il est important de mentionner que les symptômes d’une carence martiale ou d’une anémie, tels que l’épuisement, la fatigue, la dyspnée, les palpitations, etc., ne se distinguent pas ou peu des symptômes de l’insuffisance cardiaque.
On fait la distinction entre une carence martiale absolue et fonctionnelle, qui se définit, pour les patients atteints d’insuffisance cardiaque à fraction d’éjection diminuée (HFrEF), de la manière suivante: [36, 38]
Carence martiale absolue: ferritine <100μg/l
Carence martiale fonctionnelle: ferritine <300μg/l et TSAT <20%
Chez les patients atteints d’insuffisance cardiaque chronique, la carence martiale entraîne – indépendamment de la présence d’une anémie – une détérioration de la qualité de vie, une réduction des performances physiques et une augmentation de la mortalité. [38] La thérapie de la carence martiale fait donc partie intégrante du traitement de l’insuffisance cardiaque sévère.
En cas de HFrEF, seule la substitution martiale intraveineuse est efficace
Dans trois études randomisées, [39–41] l’administration intraveineuse (i.v.) de carboxymaltose ferrique chez des patients présentant une insuffisance cardiaque chronique a été étudiée. Il a été attesté que l’administration de fer i.v. a entraîné une amélioration durable des symptômes (classe NYHA), des performances physiques (test de marche de 6 minutes) et de la qualité de vie. [39–41]
L’ESC recommande donc à tous les patients atteints de HFrEF symptomatiques présentant une carence martiale une thérapie martiale i.v., qu’il y ait anémie ou non (classe IIa, niveau A). [36] Pour remédier à la carence martiale, l’administration i.v. de 500–1000mg de carboxymaltose ferrique est recommandée; si nécessaire, elle peut être réitérée au bout de 6 semaines. [38] Ferritine et TSAT devraient être contrôlées après trois mois.
Aucun effet favorable de la thérapie martiale orale n’a été attesté chez les patients insuffisants cardiaques présentant une carence en fer, de sorte qu’elle n’est pas recommandée. [38]
Réfléchissez:
Chez quels patients atteints de HFrEF l’ESC recommande-t-elle une thérapie martiale i.v.?
L’ESC recommande à tous les patients atteints de HFrEF symptomatiques présentant une carence martiale une thérapie martiale i.v., qu’il y ait anémie ou non (classe IIa, niveau A).
Compte-rendu:
Mag. Dr méd. Anita Schreiberhuber
Journaliste médicale
Review:
Dr méd. Cyril Pellaton, Médecin-chef de service de cardiologie, Réseau hospitalier neuchâtelois, Neuchâtel
Source:
Iron Academy, 8 octobre 2020, Lausanne Intervention menée par le Dr méd. Cyril Pellaton, Médecin-chef de service de cardiologie, Réseau hospitalier neuchâtelois, Neuchâtel
La dénutrition chez la personne âgée: un problème de santé publique?
Alors qu’en Suisse, en 2017, 1,6mio. des habitants avaient plus de 65 ans et 0,4mio. plus de 80 ans, ces chiffres atteindront, en 2045, 2,7 resp. 1,1mio. [42] Des chiffres qui reflètent le vieillissement croissant de la population. L’espérance de vie d’une femme de 65 ans est aujourd’hui de 21,2 ans, celle d’un homme de 65 ans de 17,9 ans, mais en moyenne, sur cette période, seulement 9,4 ans peuvent être passés en bonne santé. [43] L’augmentation de l’espérance de vie ne signifie donc pas automatiquement que la prolongation de la vie intervient en bonne santé. Un facteur essentiel qui peut aggraver la situation est la dénutrition.
Selon les résultats de l’étude «DOHEALTH», en Suisse, 17% des pensionnaires d’une maison de retraite ont des problèmes d’apport nutritionnel et 76% ont des difficultés à préparer leurs repas. [44]
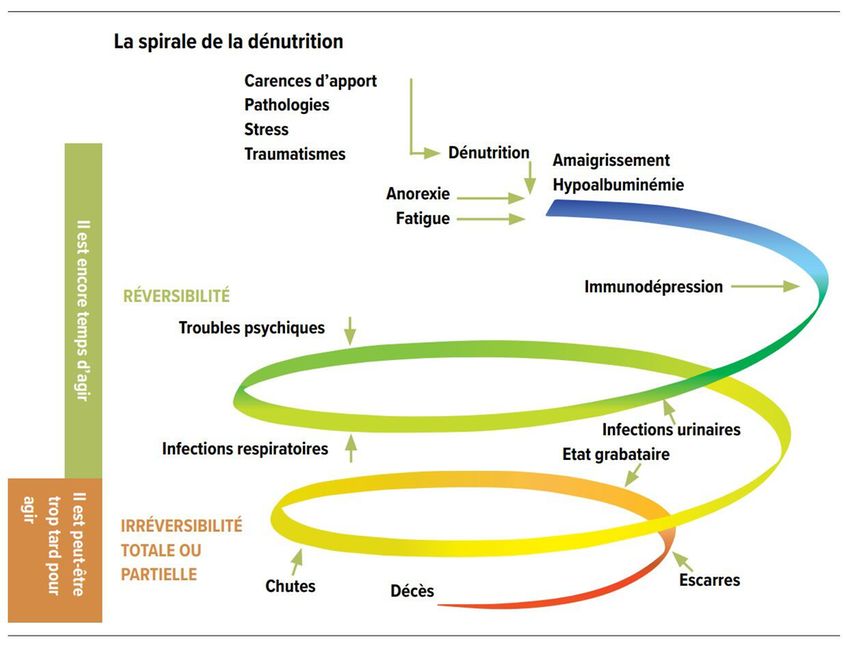
Les personnes âgées présentent plusieurs facteurs de risque de dénutrition ou des facteurs susceptibles d’aggraver une dénutrition préexistante. Ce à quoi il faut ajouter un mauvais état des dents, des difficultés de déglutition, une polymédication, des facteurs psychosociaux ou le fait que les personnes ont besoin d’aide pour les gestes du quotidien. Le médecin et nutritionniste français Monique Ferry a créé en 1992 le terme «la spirale de la dénutrition», dans lequel elle résume les facteurs qui conduisent à la dénutrition et leurs multiples conséquences pour les personnes âgées (Fig. 9). [45]
Comment peut-on dépister à temps une dénutrition?
Dans un rapport de consensus, la GLIM (Global Leadership Initiative on Malnutrition) a élaboré les critères diagnostiques de la dénutrition chez l’adulte. [46]
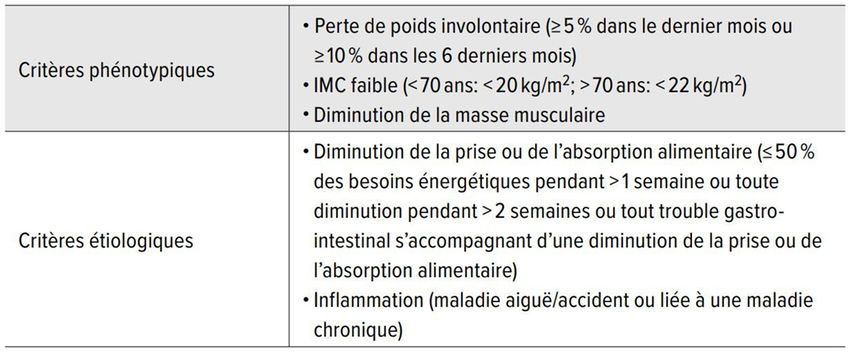
Cinq critères principaux, évocateurs d’une dénutrition, ont été identifiés. Le diagnostic de dénutrition peut être posé si au moins un critère phénotypique et un critère étiologique sont remplis (Tab. 4).
Pour évaluer la présence d’une malnutrition, les outils de dépistage recommandés sont les suivants: MUST (Malnutrition Universal Screening Tool), MNA-SF (Malnutrition Universal Screening Tool-Short Form), SNAQ65+ (Short Nutritional Assessment Questionnaire 65+) et l’instrument fréquemment utilisé dans les hôpitaux, le NRS-202 (Nutrition Risk Screening-202).
Prévention et traitement de la dénutrition
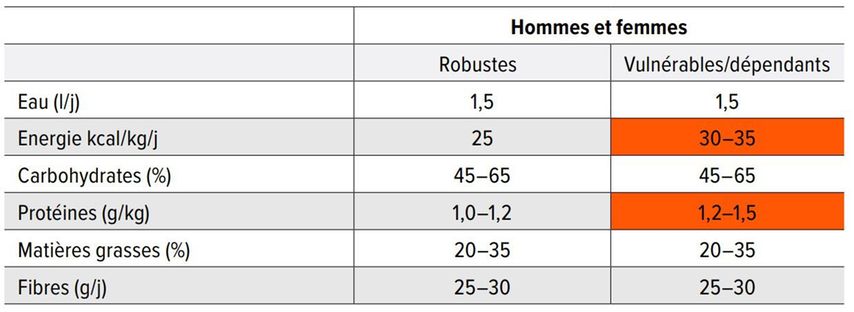
Comme le montre le tableau récapitulatif sur l’apport nutritionnel recommandé pour les personnes de plus de 65 ans, les besoins en protéines en particulier sont plus élevés chez les personnes vulnérables que chez les personnes âgées en bonne santé et en forme (Tab. 5).
Lorsque l’on dépiste une malnutrition, il convient par principe d’adapter l’alimentation aux besoins, selon l’approche la moins invasive possible. Il convient également de toujours tenir compte des facteurs de risque susmentionnés, tels que des difficultés de la déglutition, un mauvais état des dents, une polymédication, des troubles visuels, la résidence en institution et des facteurs psychosociaux, et de veiller à la pratique d’une activité physique appropriée. Des compléments alimentaires hypercaloriques peuvent être administrés le cas échéant. Par contre la nutrition par sonde nasale est très rarement conseillée.
La carence martiale comme conséquence de la dénutrition
La carence martiale est la forme la plus fréquente de déficit en micronutriments et concerne plus de 30% de la population mondiale. [47] Ainsi, le manque de fer est la cause la plus fréquente d’anémie. En outre, la carence martiale joue notamment aussi un rôle important dans les maladies qui s’accompagnent d’une inflammation chronique, ainsi que pour la fonction cérébrale. La prévalence estimée de la carence martiale dans le cadre de maladies inflammatoires chroniques est élevée et atteint, en cas d’insuffisance cardiaque chronique 50–63%, en cas d’insuffisance rénale chronique 56–73%, en cas de maladies inflammatoires chroniques de l’intestin 60–80% et en cas de tumeurs malignes 32–60%. [48] La carence martiale peut d’une part aggraver l’évolution de la maladie, mais d’autre part également être occasionnée par cette dernière.
Le fer est un cofacteur d’enzymes impliquées dans la chaîne respiratoire, par conséquent, en cas de carence martiale, la fonctionnalité des mitochondries peut être significativement compromise. Les conséquences cliniques englobent la fatigue, la léthargie et la dyspnée. [48] En raison de ses besoins en énergie élevés, le myocarde est particulièrement vulnérable face aux effets de la carence martiale.
Dans une sous-analyse de l’étude FAIRHF, on a examiné chez des patients présentant une insuffisance cardiaque chronique et une carence martiale avec ou sans anémie les effets de la carboxymaltose ferrique i.v. sur les symptômes, les performances physiques et la qualité de vie. Dans ce contexte, il s’est avéré que la thérapie martiale i.v. entraînait une amélioration significative de tous les critères d’évaluation étudiés, que les patients souffrent ou non d’anémie. [49]
Mais le fer est également requis par de nombreuses enzymes impliquées dans la réplication et la réparation de l’ADN ainsi que dans la régulation du cycle cellulaire. De plus, il revêt une importance décisive pour la croissance, la prolifération et la différenciation des cellules immunitaires. [48] La carence martiale pourrait donc également contribuer à la détérioration de la fonction immunitaire et à ce qu’on appelle l’«inflammaging». Enfin, il est également connu que l’anémie ferriprive s’accompagne d’une détérioration des fonctions cognitives. [48]
Ainsi, la détermination du statut en fer chez les personnes âgées revêt une grande importance à de nombreux égards.
Compte-rendu:
Mag. Dr méd. Anita Schreiberhuber
Journaliste médicale
Review:
Prof. Dre méd. Patrizia D’Amelio, Médecin cheffe et responsable de l’unité de soins aigus aux seniors, Service de gériatrie et réadaptation gériatrique, CHUV Centre hospitalier universitaire vaudois, Lausanne
Source:
Iron Academy, 8 octobre 2020, Lausanne Intervention menée par la Prof. Dre méd. Patrizia D’Amelio, Médecin cheffe et responsable de l’unité de soins aigus aux seniors, Service de gériatrie et réadaptation gériatrique, CHUV Centre hospitalier universitaire vaudois, Lausanne
Littérature
[1] Ligne directrice Onkopedia «Carence en fer et anémie ferriprive» de la DGHO, de l’OeGHO et de la SGHSSH, mise à jour: décembre 2018;
https://www. onkopedia.com/de/onkopedia/guidelines/eisenmangel-und-eisenmangelanaemie/@@guideline/ html/index.html
[2] Beaumont C, Karim Z: Actualité du métabolisme du fer. Rev Méd Interne 2013; 34: 17-25
[3] Martius F, Krapf R.: Erythroferrone: encore une nouvelle hormone! Forum Med Suisse 2014; 14: 896-7
[4] Camaschella C et al.: Iron metabolism and iron disorders revisited in the hepcidin era. Haematologica 2020; 105: 260-72
[5] SSGO Avis d’expert No. 48, juillet 2017. Diagnostic et traitement de l’anémie ferriprive durant la grossesse et le postpartum
https://www.sggg.ch/fileadmin/user_upload/Formulardaten/48_Eisenmangelanaemie_ersetzt_No_22_franz_13_01_2017.pdf
[6]
https://www.who.int/health-topics/anaemia#tab=tab_1
[7] Nair M et al.: Association between maternal haemoglobin and stillbirth: a cohort study among a multi-ethnic population in England. Br J Haematol 2017; 179: 829-37
[8] Corwin EJ et al.: Low hemoglobin level is a risk factor for postpartum depression. J Nutr 2003; 133: 4139-42
[9] Beard JL et al.: Maternal iron deficiency anemia affects postpartum emotions and cognition. J Nutr 2005; 135: 267-72
[10] Murray-Kolb LE, Beard JL: Iron deficiency and child and maternal health. Am J Clin Nutr 2009; 89: 946S-50S
[11] Breymann C et al.: Ferric carboxymaltose vs. oral iron in the treatment of pregnant women with iron deficiency anemia: an international, open-label, randomized controlled trial (FER-ASAP): J Perinat Med 2017; 45: 443-53
[12] Mattiello V et al.: Diagnosis and management of iron deficiency in children with or without anemia: consensus recommendations of the SPOG Pediatric Hematology Working Group. Eur J Pediatrics 2020; 179: 527-45
[13] Mattiello V et al.: Carence en fer avec et sans anémie chez l’enfant: brève mise à jour pour le praticien. Rev Méd Suisse 2019; 15: 376-81
[14] Domellöf M et al.: ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: iron and trace minerals. Clin Nutrition 2018; 37: 2354-9
[15] Hare DJ et al.: Neurological effects of iron supplementation in infancy: finding the balance between health and harm in iron-replete infants. Lancet Child Adolesc Health 2018; 2: 144-56
[16] Schmugge M et al.; SPOG Pediatric Hematology Working Group: Comment on: Intravenous ferric carboxymaltose for iron deficiency anemia or iron deficiency without anemia after poor response to oral iron treatment: Benefits and risks in a cohort of 144 children and adolescents. Pediatr Blood Cancer 2020: e28726
[17] Clénin G et al.: Iron deficiency in sports - definition, influence on performance and therapy. Swiss Med Wkly 2015; 145: w14196
[18] Wenger N et al.: La fatigue chez l’athlète adolescent. Rev Med Suisse 2019; 15: 1323-8
[19] Burden RJ et al.: Is iron treatment beneficial in, iron-deficient but non-anaemic (IDNA) endurance athletes? A systematic review and meta-analysis. Br J Sports Med 2015; 49: 1389-97
[20] Garvican LA et al.: Intravenous iron supplementation in distance runners with low or suboptimal ferritin. Med Sci Sports Exerc 2014; 46: 376-85
[21] Muñoz M et al.: ‘Fit to fly’: overcoming barriers to preoperative haemoglobin optimization in surgical patients. Br J Anaesthesia 2015; 115: 15-24
[22] Goodnough LT et al: Detection, evaluation, and management of preoperative anaemia in the elective orthopaedic surgical patient: NATA guidelines. Br J Anaesthesia 2015; 106: 13-22
[23]
www.who.int/
[24] Leahy MF et al: Improved outcomes and reduced costs associated with a health-system-wide patient blood management program: a retrospective observational study in four major adult tertiary-care hospitals. Transfusion 2017; 57; 1347-58
[25] Peters F et al.: Intravenous Iron for treatment of anemia in the 3 perisurgical phases: a review and analysis of the current literature. Anesth Analg 2018; 126: 1268-82
[26] Spiess BD: Risks of transfusion: outcome focus. Transfusion 2004; 44: 4S-14S
[27] Goodnough LT et al: Concepts of blood transfusion in adults. Lancet 2013; 381: 1845-54
[28]
www.smartermedicine.ch
[29] Spahn DR et al.: Le «patient blood management» est aujourd’hui standard. Forum Med Suisse 2017; 17: 1145-7
[30] Ligne directrice Onkopedia «Carence en fer et anémie ferriprive» de la DGHO, de l’OeGHO et de la SGHSSH, mise à jour: décembre 2018;
https://www.onkopedia.com/de/onkopedia/ guidelines/eisenmangel-und-eisenmangelanaemie/@@guideline/html/index.html
[31] Ballas SK: Iron overload is a determinant of morbidity and mortality in adult patients with sickle cell disease. Semin Hematol 2001; 38(1 Suppl 1): 30-6
[32] Knutson MD et al.: Non-transferrin-bound iron transporters. Free Radic Biol Med 2019; 133: 101-11
[33] Krayenbühl P et al.: [Hemochromatosis (hereditary, „primary” hemochromatosis)]. Praxis 2007; 96: 2029-3
[34] Saglini V et al.: Dépistage de l'hémochromatose génétique. Rev Med Suisse 2007; 3: 32505
[35] Waeber G et al.: Hyperferritinémie associée au syndrome métabolique: une nouvelle cible thérapeutique? Rev Med Suisse 2013; 9: 2002-7
[36] Ponikowski P et al.: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37: 2129-200
[37] Peri-Okonny P et al.: Target doses of heart failure medical therapy and blood pressure: insights from the CHAMP-HF Registry. JACC Heart Fail 2019: 7: 350-8
[38] Gstrein C et al.: Iron substitution in the treatment of chronic heart failure. Swiss Med Wkly 2017; 147: w14453
[39] Anker SD et al.; FAIR-HF Trial Investigators: Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009; 25: 2436-48
[40] Ponikowski P et al.; CONFIRM-HF Investigators: Beneficial effects of longterm intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J 2015; 11: 657- 68
[41] van Veldhuisen DJ et al.: Effect of ferric carboxymaltose on exercise capacity in patients with chronic heart failure and iron deficiency. Circulation 2017; 136: 1374-83
[42]
https://www.bfs.admin.ch/ bfs/fr/home/statistiques/population/vieillissement. assetdetail.6107332.html
(accès: 25 octobre 2020)
[43] Healthy life years and life expectancy at age 65 by sex. Eurostat, European Commission, Luxemburg. 2016
[44] Étude DO-HEALTH:
http://www.alterundmobilitaet.usz.ch/forschung/klinische-studien/seiten/do-health.aspx
[45] Ferry M.: La spirale de la dénutrition. Société Française de Gériatrie et Gérontologie. 1992
[46] Cederholm T et al.; GLIM Core Leadership Committee; GLIM Working Group: GLIM criteria for the diagnosis of malnutrition - Aconsensus report from the global clinical nutrition community. Clin Nutr 2019; 38: 1-9
[47] De Benoist B et al.: Worldwide prevalence of anaemia 1993– 2005. WHO Global Database on Anaemia. World Health Organization, Geneva, 2008
[48] Musallam KM, Taher AT: Iron deficiency beyond erythropoiesis: should we be concerned? Curr Med Res Opin 2018; 34: 81-93
[49] Filippatos G et al.: Intravenous ferric carboxymaltose in iron-deficient chronic heart failure patients with and without anaemia: a subanalysis of the FAIR-HF trial. Eur J Heart Fail 2013: 15: 1267-76