Einleitung
Die chronische lymphatische Leukämie (CLL) stellt mit jährlich 4,8 Neuerkrankungen pro 100 000 Einwohner die häufigste Leukämie in Europa und Nordamerika dar. [1] Betroffene sind zum Zeitpunkt der Erstdiagnose im Durchschnitt 72 Jahre alt.
Diagnostische Kriterien
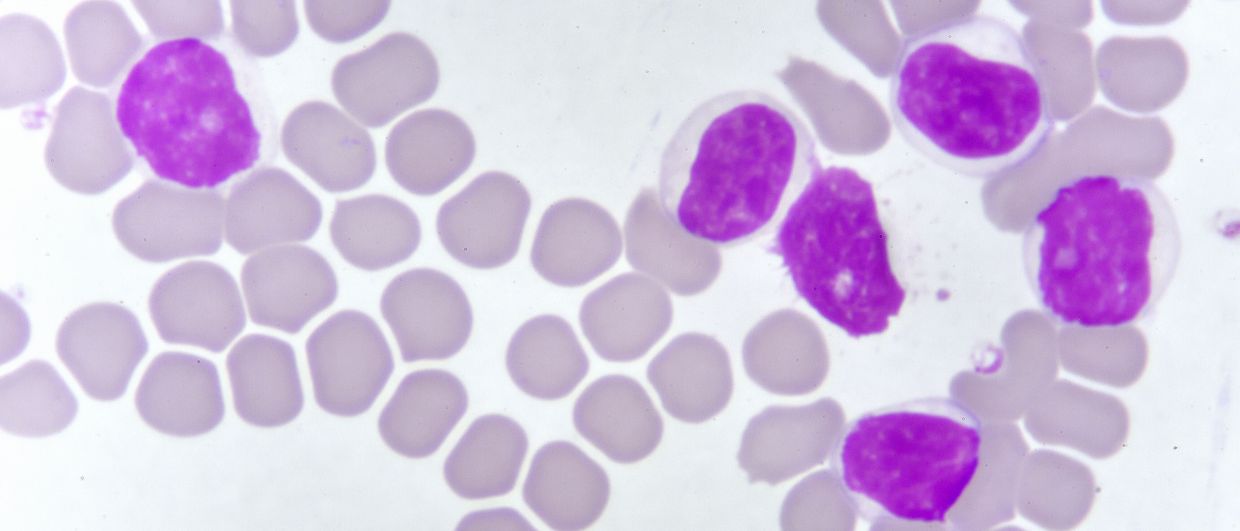
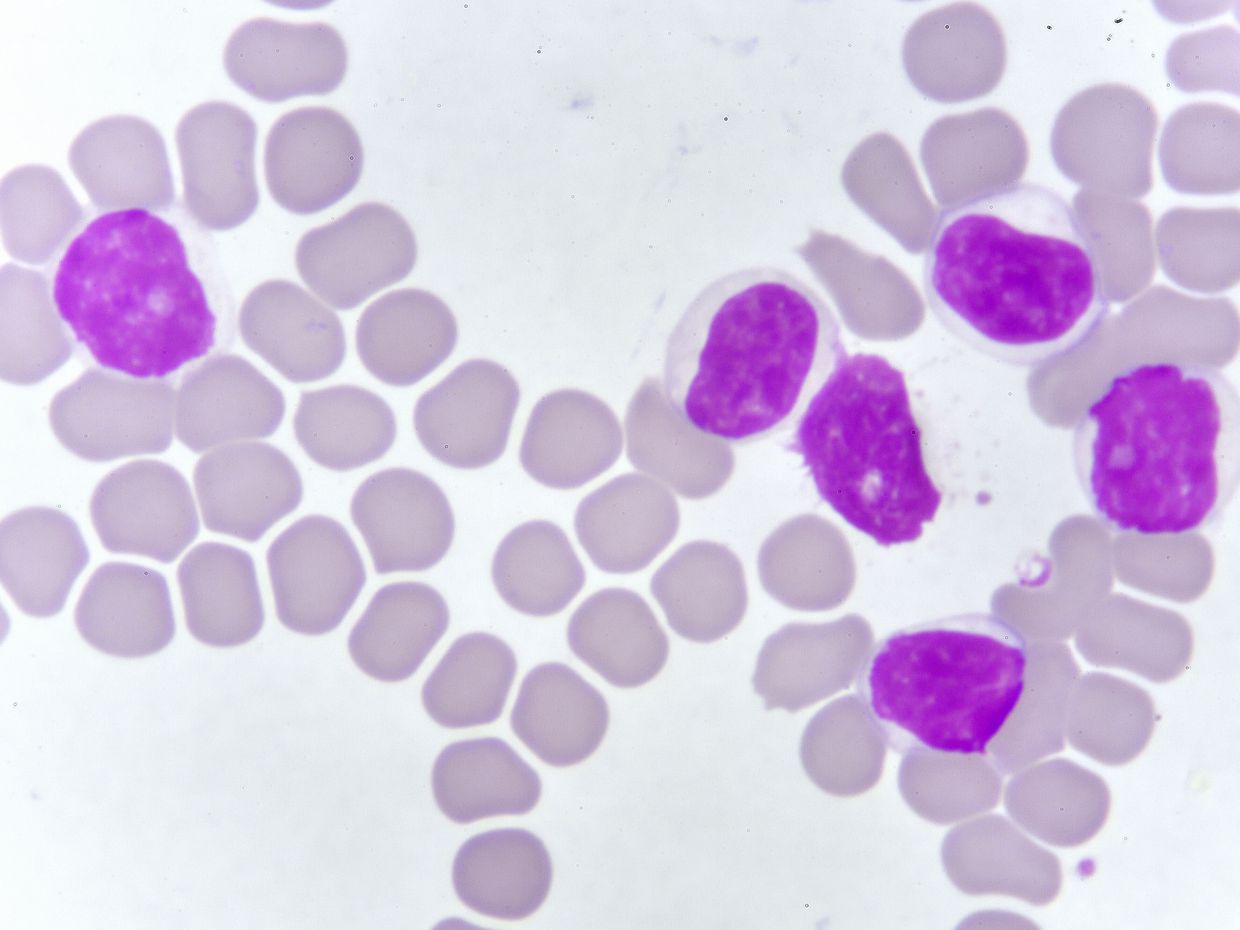
Zur Diagnose einer CLL sind ein Blutbild mit Differenzierung, ein Blutausstrich und eine Immunphänotypisierung notwendig. Als diagnostisch für eine CLL gilt der über mindestens drei Monate anhaltende Nachweis von ≥ 5 x 109/L klonalen B-Lymphozyten im peripheren Blut. [2, •3] Im Blutausstrich überwiegen kleine, morphologisch reif wirkende Lymphozyten mit marmorierter Kernstruktur. Im Rahmen eines Harmonisierungsprojekts im Bereich Immunphänotypisierung wurde festgestellt, dass zur Bestätigung der Diagnose der Nachweis von CD19, CD5, CD20, CD23 und κ- sowie λ-Leichtketten meist genügt. [4] CLL-Zellen koexprimieren das CD5-Antigen zusammen mit den B-Zell-Antigenen CD19, CD20 und CD23 sowie entweder κ- oder λ-Immunglobulin-Leichtketten.
Staging und Risikostratifizierung
Mit der Rai- und Binet-Klassifikation existieren bei der CLL zwei breit akzeptierte Systeme zum Staging der Patienten. [5, 6] Diese Klassifikationen teilen die Patienten anhand von Laborparametern wie Hämoglobinwert und Thrombozytenzahl sowie der klinisch feststellbaren Lymphknoten-, Milz- oder Lebervergrösserung (Anzahl betroffener Körperregionen) in verschiedene Stadien ein.
Zudem wurden in den letzten Jahren zahlreiche Biomarker mit prognostischer Relevanz identifiziert. [7–9] Als prognostisch ungünstig angesehen werden dabei unter anderem eine del(17p), eine del(11q), eine TP53-Mutation, unmutierte variable Segmente der Immunglobulinschwerketten-Gene (IGHV) sowie ein erhöhtes Serum-β-Mikroglobulin. Einige dieser Parameter fliessen denn auch in den vor einigen Jahren entwickelten CLL International Prognostic Index (CLL-IPI) ein. [10] Dieser Index teilt die Patienten in vier prognostische Kategorien ein. Das 5-JahresGesamtüberleben bei Behandlung mit konventioneller Chemoimmuntherapie lag dabei in der Gruppe mit dem niedrigsten Risiko bei 93,2 % und in der Gruppe mit sehr hohem Risiko bei 23,3 %. [9]
Therapieindikation und prätherapeutische Untersuchungen
Ob eine neu diagnostizierte CLL behandelt wird, hängt davon ab, in welchem Erkrankungsstadium sich der Patient befindet und ob er Symptome aufweist. Generell gilt, dass asymptomatische Patienten in einem frühen Erkrankungsstadium (Rai 0–2, Binet A + B) lediglich überwacht werden sollten («watch and wait»). [2] Mehrere Studien haben gezeigt, dass die Behandlung dieser Patienten zu keinem Überlebensvorteil führt. Selbst beim Vorliegen von Risikofaktoren ist eine Behandlung dieser Patienten allenfalls innerhalb klinischer Studien angezeigt. [1]
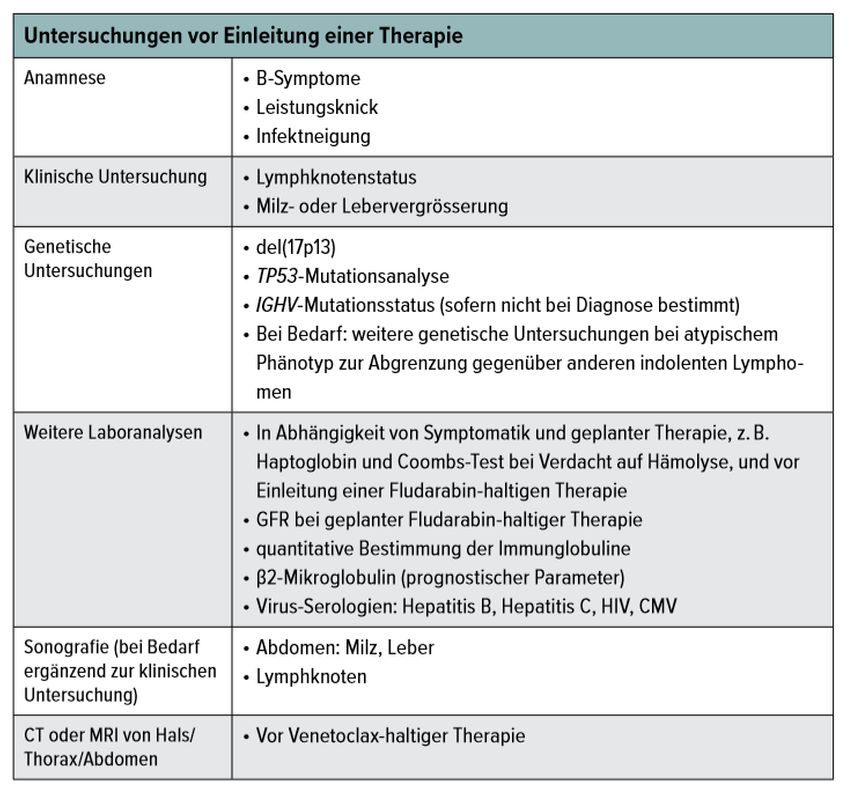
Vor Beginn einer CLL-Behandlung sollten verschiedene zusätzliche Untersuchungen durchgeführt werden (Tab. 1). Dies einerseits, um das Ansprechen auf konventionelle Chemoimmuntherapien abschätzen zu können, andererseits um zu beurteilen, ob ein Patient körperlich fit genug ist, bestimmte Therapien zu tolerieren. [•11]
Eine Behandlungsindikation besteht im Stadium Binet C sowie im Stadium Binet B oder A, falls weitere Kriterien erfüllt sind: [•11]
Auftreten/Verschlechterung einer Anämie/Thrombozytopenie infolge einer durch die CLL-verursachten Knochenmarkinsuffizienz
Massive (> 6 cm unter dem Rippenbogen), progrediente oder symptomatische Splenomegalie
Massive (> 10 cm im Durchmesser), progrediente oder symptomatische Lymphadenopathie
Lymphozytenverdopplungszeit von weniger als 6 Monaten oder 50 %iger Anstieg in 2 Monaten, ausgehend von einem Basiswert von mindestens 30 x 109/L und nach Ausschluss anderer Ursachen für eine Zunahme der Lymphozytose (z. B. Steroidtherapie, Infektionen)
Auf Standardtherapie refraktäre Autoimmunzytopenie
Eines der folgenden konstitutionellen Symptome
Ungewollter Gewichtsverlust > 10 % in 6 Monaten
Fieber unklarer Ursache für mehr als 2 Wochen
Nachtschweiss über mehr als einen Monat ohne Nachweis einer Infektion
Schwerwiegende Fatigue (Einschränkung der Arbeitsfähigkeit)
Erstlinientherapie
Für die Erstlinientherapie einer CLL stehen verschiedene Optionen zur Verfügung. Die Therapiewahl orientiert sich dabei an den genetischen Veränderungen der Erkrankung, an der Belastung des Patienten durch allfällige Komorbiditäten, z. B. anhand des CIRS (Cumulative Illness Rating Scale)-Scores und der Nierenfunktion. [•11] Neben der Chemoimmuntherapie stehen heute auch gezielte Therapien zur Verfügung und die Palette an Optionen erweitert sich laufend.
Chemoimmuntherapie
Seit den Resultaten der CLL8-Studie wird die bis dahin bei CLL eingesetzte Chemotherapie mit Fludarabin (F) und Cyclophosphamid (C) standardmässig in Kombination mit dem CD20-Antikörper Rituximab (R) verabreicht (FCR). [12] In dieser Studie waren 3 Jahre nach Randomisierung noch 65 % der Patienten der FCR-Gruppe ohne Progression im Vergleich zu 45 % in der FC-Gruppe (HR: 0,56; 95 % CI: 0,46–0,69; p < 0,0001), 87 % bzw. 83 % der Patienten waren am Leben. Unter der Chemoimmuntherapie FCR traten jedoch Neutropenien und Leukopenien vom Grad 3/4 häufiger auf als unter FC.
In der CLL10-Studie wurde FCR mit der Kombination aus Bendamustin und Rituximab (BR) verglichen. [13] Dabei konnte für BR zwar keine bessere Wirksamkeit, dafür aber ein günstigeres Toxizitätsprofil (seltener schwere Neutropenien und Infektionen) festgestellt werden. BR wird daher vor allem für den Einsatz bei fitten, aber über 65 Jahre alten Patienten empfohlen. [•11, 14] In der MABLE-Studie – sie schloss für eine fludarabinhaltige Therapie nicht geeignete Patienten ein – führte BR im Vergleich zu Chlorambucil/Rituximab zu einem signifikant längeren progressionsfreien Überleben (PFS) bei gleichem Gesamtüberleben (OS). [15] Daher kann BR auch für Patienten mit leicht bis mässig eingeschränkter Nierenfunktion oder Begleiterkrankungen empfohlen werden, aufgrund derer eine Fludarabin-haltige Therapie nicht infrage kommt. Die CLL11-Studie schliesslich zeigte, dass bei älteren Patienten mit Komorbiditäten die Kombination aus Chlorambucil und dem neuen CD20-Antikörper Obinutuzumab im Vergleich zu Chlorambucil/Rituximab zu höheren Raten kompletter Remissionen sowie einer deutlichen Verlängerung des PFS und, nach längerem Follow-up, auch des OS führte. [16, 17]
Anhand der Patienten aus der CLL8-Studie konnten Böttcher et al. bestätigen, dass die minimale Residualerkrankung (Minimal Residual Disease, MRD) ein von der Therapie unabhängiger Prädiktor für das PFS und OS darstellt. [18] Stilgenbauer et al. konnten zeigen, dass weitere genetische Marker einen starken Einfluss auf das Therapieansprechen und das OS aufweisen. [19] Insbesondere TP53- und SF3B1-Mutationen erwiesen sich als unabhängige prognostisch ungünstige Marker. Patienten mit einer NOTCH1-Mutation konnten zudem nicht von der Zugabe von Rituximab zu einer Chemotherapie mit FC profitieren. Auch Patienten mit BIRC3-Mutationen scheinen ungenügend auf eine Chemoimmuntherapie anzusprechen. [20]
Thompson et al. zeigten schliesslich deutlich, dass FCR nur bei Patienten mit IGHV-mutierter CLL ohne del(17p13) zu einer sehr guten und lang anhaltenden Krankheitskontrolle führen kann. Das 12,8-Jahres-PFS lag bei 53,9 % für Patienten mit IGHVmut, aber nur bei 8,7 % bei einer IGHVunmut Erkrankung. [21] Das entsprechende OS betrug 65,5 % für Patienten mit IGHVmut und 32,2 % für IGHVunmut.
Gezielte Therapien
Gezielte Therapien spielen bei der CLL eine zunehmend wichtigere Rolle. Ibrutinib, ein Hemmer der Bruton-Tyrosinkinase (BTK), bewirkte in der Studie RESONATE-2 bei komorbiden Patienten ≥ 65 Jahre im Vergleich zu Chlorambucil ein signifikant besseres 18-Monats-PFS (90 % vs. 52 %) und 24-Monats-OS (98 % vs. 85 %) sowie eine signifikant höhere Remissionsrate (Gesamtansprechrate: 86 % vs. 35 %). [22] Die Vorteile von Ibrutinib blieben auch über ein Follow-up von 5 Jahren erhalten (PFS: 70 % vs. 12 %). [23] Wie sich zeigte, konnten besonders auch Patienten mit einem ungünstigen Risikoprofil (TP53-Mutation, del[11q] und/oder IGHVunmut) von Ibrutinib profitieren. In der iLLUMINATE-Studie bei (meist älteren) Patienten mit Komorbiditäten schnitt die Kombination Ibrutinib-Obinutuzumab unabhängig von Risikofaktoren besser ab als Chlorambucil-Obinutuzumab, zumindest in Bezug auf das PFS. Das OS verlängerte sich in dieser Studie jedoch nicht. [24] Die Nachbeobachtungszeit ist allerdings erst kurz.
Als weitere, gezielt wirkende Therapie wurde in der CLL14-Studie der BCL2-Inhibitor Venetoclax in Kombination mit Obinutuzumab als zeitlich für ein Jahr befristete Therapie bei Patienten mit Komorbiditäten eingesetzt. Diese Kombination erreichte mit einem 2-Jahres-PFS von 88,2 % ein signifikant besseres Resultat als die Standard-Chemoimmuntherapie mit Chlorambucil-Obinutuzumab (2-Jahres-PFS: 64,1 %). [25]
In der ALLIANCE-Studie wurde bei mindestens 65-jährigen, «fitten» CLL-Patienten Ibrutinib – alleine oder in Kombination mit Rituximab – mit der Chemoimmuntherapie BR verglichen. Die Ibrutinib-Monotherapie erwies sich dabei in Bezug auf das PFS gegenüber BR als überlegen. Zwischen Ibrutinib als Monotherapie und seiner Kombination mit Rituximab ergab sich kein signifikanter Unterschied. [26] In der E1912-Studie wurden Ibrutinib und Rituximab (IR) mit FCR verglichen. [27, 28] Bei einem Follow-up von mittlerweile 45 Monaten zeigte IR nach wie vor ein signifikant längeres PFS als FCR. Besonders die Subgruppe der IGHV-unmutierten Patienten erreichte mit IR ein signifikant längeres PFS als mit FCR. Bei einer niedrigen Anzahl an Todesfällen war auch das Gesamtüberleben mit IR länger als mit FCR, in erster Linie bedingt durch die deutlich schlechtere Prognose der IGHV-unmutierten Patienten nach FCR.
Konzept für die Erstlinientherapie
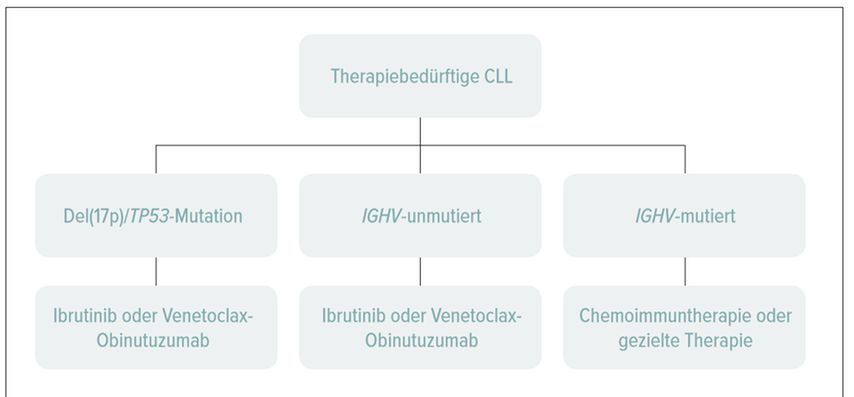
Aufgrund der aktuellen Datenlage empfiehlt sich folgendes Konzept für die Wahl der Erstlinientherapie (Abb. 1):
Bei Patienten mit del(17p)/TP53-Mutation: Ibrutinib oder Venetoclax-Obinutuzumab (Letzteres ist in der Schweiz nicht zugelassen.)
Bei IGHV-unmutierten Patienten: Ibrutinib oder Venetoclax-Obinutuzumab sind gegenüber einer Chemoimmuntherapie (FCR, BR, Chlorambucil-Obinutuzumab) zu bevorzugen.
Bei IGHV-mutierten Patienten: Eine Chemoimmuntherapie ist gleichwertig mit einer gezielten Therapie. Aufgrund der längeren Erfahrung und niedrigeren Kosten stellt sie gegenüber Venetoclax-Obinutuzumab oder Ibrutinib weiterhin eine gute Option dar.
Rezidivtherapie
Die Wahl der Rezidivtherapie hängt von Faktoren wie Alter und Komorbiditäten, von Parametern wie der Art der Primärtherapie, der damit erreichten Remissionsdauer und von biologischen Charakteristiken der Erkrankung ab (z. B. del[17p] bzw. TP53-Mutation). [•11] Da sich solche biologischen Faktoren (mit Ausnahme des IGHV-Mutationsstatus) im Laufe einer CLL auch verändern können, sollten vor dem Start einer Rezidivtherapie die prätherapeutischen Untersuchungen wiederholt werden. Bei klinischen Hinweisen (z. B. asymmetrisches Wachstum von Lymphknoten, B-Symptome, inadäquate LDH-Erhöhung) gilt es zudem, mithilfe einer Lymphknotenbiopsie (oder ggf. Biopsie eines anderen Gewebes) eine Richter-Transformation auszuschliessen. [2]
Chemoimmuntherapie
Bei Patienten mit einem ersten CLL-Rezidiv verglich die REACH-Studie die Chemoimmuntherapie FCR mit der Kombinationschemotherapie FC. [29] FCR führte hier zu einem signifikant längeren PFS als FC. Auch andere Parameter wie Ansprechrate und -dauer, die Zeit bis zur nächsten CLL-Therapie sowie das ereignisfreie Überleben waren unter FCR signifikant besser.
Die Chemoimmuntherapie mit FCR zeigte auch in einer Phase-II-Studie hohe Ansprechraten (Gesamtansprechrate: 74 %), ein geschätztes medianes PFS von 21 Monaten und ein geschätztes medianes OS von 47 Monaten (allerdings ohne Verfügbarkeit heutiger gezielter Therapien im Rezidiv!). Besonders Patienten mit ≤ 3 Vortherapien, ohne Fludarabin-Resistenz oder Patienten ohne Hochrisiko-Zytogenetik (Chromosom 17 oder komplexe zytogenetische Anomalien) zeigten öfters ein gutes und teils länger anhaltendes Ansprechen. [30] Die Zugabe von R zu FC hat somit sowohl die Erstlinien- als auch die Rezidivtherapie der CLL verbessert, auch wenn das mediane PFS nur 21 bis 30 Monate beträgt.
Fischer et al. untersuchten BR in einer Phase-II-Studie als Rezidivbehandlung. [31] Ihre Arbeit schloss einen relevanten Anteil an Fludarabin-refraktären Patienten sowie einen hohen Anteil an Patienten mit einer del(17p) und IGHVunmut Erkrankung ein. Die Behandlung erwies sich als gut verträglich und wirksam. Die Gesamtansprechrate betrug 59 %. Von den Fludarabin-refraktären Patienten sprachen 45,5 % an, von den Patienten mit del(17p) 7,1 % und von den Patienten mit IGHVunmut-Status 58,7 %. Nach einem medianen Follow-up von 24 Monaten betrug das mediane PFS 15,2 Monate (del[17p] 6,8 Monate, IGHVunmut 13,8 Monate).
Generell muss gesagt werden, dass mit Chemoimmuntherapien die Remissionsdauer im Rezidiv mit 1,5 bis 2,5 Jahren kurz ist (abhängig von Genetik sowie Art und Ansprechdauer auf die Vortherapie).
Überlegen Sie:
Was sollte in der Rezidivsituation auf jeden Fall überprüft werden?
Anamnese, klinische Untersuchung, genetische Untersuchungen (del[17p13], TP53, IGHV), weitere Laboranalysen, Sonografie, CT oder MRI von Hals/Thorax/ Abdomen. Bei klinischen Hinweisen sollte mit einer Lymphknotenbiopsie eine Richter-Transformation ausgeschlossen werden.
Gezielte Therapien
Patienten mit einer primären Resistenz gegenüber einer Erstlinien-Chemo(immun)therapie, einer progressionsfreien Zeit von weniger als 3 Jahren nach einer Fludarabinhaltigen Erstlinien-Chemo(immun)therapie sowie Patienten mit del(17p)/TP53-Mutationen sprechen in der Regel ungenügend auf eine Zweitlinien-Chemoimmuntherapie an. [2] Bei diesen Patienten kommen folgende Optionen, bzw. der Einschluss in klinische Studien, infrage:
Ibrutinib: Der BTK-Inhibitor Ibrutinib führte in der RESONATE-Studie im Vergleich zum CD20-Antikörper Ofatumumab zu einer signifikanten Verlängerung des PFS und OS. [32] Die finale Analyse der Studie ergab ein medianes PFS von 44,1 Monaten für Ibrutinib vs. 8,1 Monate für Ofatumumab. [33] Bei häufig genutzter Möglichkeit eines Cross-overs von Ofatumumab zu Ibrutinib ergab sich ein Trend für längeres OS für die initial mit Ibrutinib behandelten Patienten (HR: 0,81; 95 % CI: 0,60–1,09).
Idelalisib und Rituximab: Bei Patienten, die aufgrund einer zytotoxischen Vortherapie, einer eingeschränkten Nierenfunktion oder von Komorbiditäten (CIRS > 6) für eine Chemoimmuntherapie nicht in Betracht kamen, führte der PI3Kδ-Inhibitor Idelalisib kombiniert mit Rituximab im Vergleich zu einer Rituximab-Monotherapie (in Europa weder zugelassener noch üblicher Vergleichsarm!) zu einer signifikanten Verlängerung des PFS und OS. [34]
Venetoclax und Rituximab: In der MURANO-Studie wurde eine zeitlich begrenzte Behandlung (2 Jahre) mit Venetoclax und Rituximab (VenR) mit einer Standardbehandlung mit BR verglichen. [35] Ein kürzlich präsentiertes Update der Studie mit einem medianen Follow-up von 48 Monaten bestätigte den bereits in den früheren Analysen gezeigten Vorteil von VenR gegenüber BR hinsichtlich PFS (HR: 0,19; p < 0,0001) und OS. [36] Bei den Patienten, welche die 2-jährige Therapie mit VenR abgeschlossen hatten, betrug das PFS 24 Monate nach Therapieabschluss (bzw. 4 Jahre nach Therapiebeginn) 68 %. Patienten mit einer nicht mehr nachweisbaren MRD erreichten besonders häufig ein anhaltendes Ansprechen. Auch bezüglich OS (4-Jahres-OS: VenR 85,3 %, BR 66,8 %; HR: 0,41; p < 0,0001) ergab sich ein anhaltender Vorteil von VenR. Die Resultate von MURANO sprechen dafür, dass CLLPatienten mit einer zeitlich begrenzten chemotherapiefreien Behandlung mit Venetoclax und Rituximab auch im Rezidiv längerfristig ohne Krankheitsaktivität bleiben können.
Konzept für die Rezidivtherapie
Aufgrund der aktuellen Datenlage empfiehlt sich folgendes Konzept für die Wahl der Rezidivtherapie:
Gezielte Therapien werden im Rezidiv generell bevorzugt.
Im Rezidiv neu aufgetretene del(17p)/ TP53-Mutation: Venetoclax-Rituximab oder Ibrutinib (oder Idelalisib-Rituximab)
Bereits vorbestehende del(17p)/TP53-Mutation: Wechsel zwischen Venetoclax-Rituximab oder Ibrutinib (oder Idelalisib-Rituximab)
Keine del(17p)/TP53-Mutation: je nach Zulassungsstatus Venetoclax-Rituximab («Rezidiv»), Ibrutinib («Frührezidiv») oder Idelalisib-Rituximab («Frührezidiv» und Ibrutinib oder Venetoclax-Rituximab nicht möglich)
Chemoimmuntherapie nur in Ausnahmefällen bei Spätrezidiv mit günstigen genetischen Eigenschaften (IGHVmut, keine del[17p], keine TP53-Mutation), wenn gezielte Therapien nicht eingesetzt werden können/nicht verfügbar sind
Allogene Stammzelltransplantation
Der Stellenwert der allogenen Stammzelltransplantation (SZT) hat durch die Verfügbarkeit von hochwirksamen gezielten Therapien in den letzten Jahren abgenommen. Für Patienten, die trotz moderner Therapien weiterhin eine relativ ungünstige Prognose aufweisen, bleibt sie jedoch eine gute, potenziell kurative Option. Die European Research Initiative on CLL (ERIC) und die European Society for Blood and Marrow Transplantation (EBMT) sehen eine allogene SZT nur bei Patienten vor, bei denen eine Langzeitkontrolle mit gezielten Substanzen nicht zu erwarten ist. [37]
Blick in die Zukunft
Die Entwicklungen auf dem Gebiet der CLL schreiten laufend voran. So wird unter anderem nach neuen prognostischen und prädiktiven Faktoren für ein Ansprechen auf die gezielten Therapien gesucht, um so ihren Einsatz zu optimieren.
Als mögliche neue Therapieoptionen werden unter anderem die Kombinationen Venetoclax-Ibrutinib sowie VenetoclaxIbrutinib-Obinutuzumab, sowohl in der Rezidivsituation als auch als Erstlinientherapie, untersucht. [37] Jain et al. setzten Ibrutinib und Venetoclax als Erstlinientherapie bei älteren und Hochrisikopatienten ein. Nach 12 Zyklen der kombinierten Gabe stellten sie eine CR/CRi-Rate von 88 % fest, 61 % der Patienten wiesen eine nicht mehr nachweisbare MRD (uMRD) im Knochenmark auf. [38] Das Update der Studie mit einem medianen Follow-up von 27 Monaten ergab nach 24 Zyklen eine uMRD-Rate von 75 %. [39] Weder das mediane PFS noch das mediane OS waren erreicht.
Bei rezidivierten/refraktären CLL-Patienten führten 24 Zyklen Ibrutinib-Venetoclax nach einem medianen Follow-up von 22,3 Monaten zu einer uMRD-Rate von 67 %. [40] Auch hier waren das mediane PFS und OS nicht erreicht. Rogers et al. setzten die Dreierkombination Venetoclax-Ibrutinib-Obinutuzumab bei rezidivierten/refraktären sowie bisher unbehandelten CLL-Patienten ein. [41, 42] Auch damit liessen sich hohe Ansprechraten und bei einem Teil der Patienten auch eine uMRD erreichen. Das Nebenwirkungsprofil stimmte mit dem bekannten Profil der einzelnen Substanzen überein. Insbesondere wurde kein Fall eines Tumorlysesyndroms registriert.
Therapie-naive CLL-Patienten (≥ 65 Jahre oder < 65 Jahren mit Komorbiditäten) werden in der Studie ELEVATE TN untersucht. [43] Sie evaluiert die Wirksamkeit und Sicherheit des hochselektiven BTK-Hemmers der zweiten Generation, Acalabrutinib (Acala), im Vergleich zu Acalabrutinib + Obinutuzumab (Acala-O) vs. Obinutuzumab + Chlorambucil (O-Clb). Acala-O sowie eine Acala-Monotherapie führten nach einem medianen Follow-up von 28 Monaten zu einem signifikant längeren PFS als O-Clb (HR Acala-O vs. O-Clb: 0,10; p < 0,0001; HR Acala vs. O-Clb: 0,20; p < 0,0001). Das mediane Gesamtüberleben (OS) wurde in keinem Behandlungsarm erreicht. Als Nebenwirkungen von besonderem Interesse wurden in den Acala-haltigen Therapiearmen unter anderem Vorhofflimmern, Hypertonie und Blutungen beobachtet (wie bekannt von Ibrutinib, möglicherweise seltener, aber keine sichere Aussage bezüglich Häufigkeit ohne direkten Vergleich).
Weitere BTK-Inhibitoren werden derzeit in Phase-II- und Phase-III-Studien geprüft.
Duvelisib, ein PI3Kδ-Hemmer, führte in einer Phase-III-Studie bei rezidivierten CLL-Patienten im Vergleich zu Ofatumumab zu einem signifikant längeren PFS und einer signifikant höheren Gesamtansprechrate bei einem handhabbaren Nebenwirkungsprofil. [44]
Zusammenfassung der in diesem med·Diplom vermittelten Lerninhalte
Die Therapie der CLL hat sich in den letzten fünf Jahren wesentlich verändert. Gezielt wirkende Substanzen haben, zunächst in der Rezidivtherapie, einen festen Platz in der Behandlung dieser Erkrankung erhalten. In der Ersttherapie der CLL zeigten mehrere randomisierte Studien Vorteile für Ibrutinib (teils kombiniert mit Rituximab oder Obinutuzumab) sowie Venetoclax kombiniert mit Obinutuzumab im Vergleich zur Chemoimmuntherapie als bisherigem Therapiestandard. Dieser Vorteil ist am ausgeprägtesten bei Patienten mit Hochrisiko-CLL. Die Kombination von gezielt wirkenden Molekülen aus verschiedenen Substanzklassen, wie BTK-Inhibitoren (Ibrutinib oder Acalabrutinib) und BCL2-Inhibitoren (Venetoclax), scheint eine synergistische Wirkung zu haben. Diese Kombinationen, allenfalls ergänzt durch monoklonale Antikörper, sind die derzeit vielversprechendsten Therapieoptionen.
Schliesslich sucht die aktuelle Forschung nach prädiktiven Faktoren für den Einsatz zielgerichteter Substanzen, um diese bei jedem Patienten in einer optimalen Kombination und Therapiesequenz einsetzen zu können.
Klinische Relevanz
Im klinischen Alltag kann bereits heute bei der Mehrzahl der CLL-Patienten mit zielgerichteten Therapien eine langfristige Krankheitskontrolle bei guter Lebensqualität erreicht werden.
Das sollten Sie lesen:
Der Autor empfiehlt folgende Referenzen als wissenschaftlich und/oder praktisch besonders relevant (im Text und in der Literaturliste markiert mit •).
[3•] Hallek M: Chronic lymphocytic leukemia: 2020 update on diagnosis, risk stratification and treatment. Am J Hematol 2019; 94: 1266-87
[11•] Wendtner CM et al.: Onkopedia-Leitlinie Chronische Lymphatische Leukämie. Version April 2019. Verfügbar unter: www.onkopedia.com
Literatur
[1] Goede V, Hellmich S.: Übersicht chronische lymphatische Leukämie. Kompetenznetz maligne Lymphome. Verfügbar unter www.lymphome.de/InfoLymphome/ChronLymphatLeukaemie/index.jsp
[2] Hallek M et al.: iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood 2018; 131: 2745-60
[3•] Hallek M: Chronic lymphocytic leukemia: 2020 update on diagnosis, risk stratification and treatment. Am J Hematol 2019; 94: 1266-87
[4] Rawstron AC et al.: Reproducible diagnosis of chronic lymphocytic leukemia by flow cytom etry: an European Research Initiative on CLL (ERIC) & European Society for Clinical Cell Analysis (ESCCA) harmonisation project. Cytometry B 2018; 94: 121-8
[5] Rai KR et al.: Clinical staging of chron ic lymphocytic leukemia. Blood 1975; 46: 219-34
[6] Binet JL et al.: A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981; 48: 198-204
[7] Damle RN et al.: Ig V gene muta
tion status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999; 94: 1840-47
[8] Döhner H et al.: 11q deletions identify a new subset of B-cell chronic lymphocytic leukemia characterized by extensive nodal involvement and inferior prognosis. Blood 1997; 89: 2516-22
[9] International CLL-IPI working group: An international prognostic index for patients with chronic lymphocytic leukaemia (CLLIPI): a meta-analysis of individual patient data. Lancet Oncol 2016; 17: 779-90
[10] Zenz T et al.: TP53 mutation and survival in chronic lymphocytic
leukemia. J Clin Oncol 2010; 28(29): 4473-9
[11•] Wendtner CM et al.: Onkopedia-Leitlinie Chronische Lymphatische Leukämie. Version April 2019. Verfügbar unter:
www.onkopedia.com
[12] Hallek M et al.: Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet 2010; 376: 1164-74
[13] Eichhorst BF et al.: First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol 2016; 17: 928-42
[14] Fischer K et al.: Bendamustine in combination with rituximab for previously untreat ed patients with chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2012; 30: 3209-16
[15] Michallet AS et al.: Rituximab plus bendamustine or chlorambucil for chronic lymphocytic leukemia: primary analysis of the randomized, open-label MABLE study. Haematologica 2018; 103: 698-706
[16] Goede V et al.: Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370: 1101-10
[17] Goede V et al.: Overall survival ben efit of obinutuzumab over rituximab when combined with chlroambucil in patients with chronic lymphocytic leukemia and comorbidities. Final survial analysis of the CLL11 study. EHA23 2018, Presidential Symposium, Abstract S151
[18] Böttcher S et al.: Minimal residual disease quantification is an independent predictor of progression-free and overall survival in chronic lymphocytic leukemia: a multivariate analysis from the randomized GCLLSG CLL8 trial. J Clin Oncol 2012; 30: 980-88
[19] Stilgenbauer S et al.: Gene mutations and treatment outcome in chronic lymphocytic leukemia: results from the CLL8 trial. Blood 2014; 123: 3247-54
[20] Diop F et al.: Biological and clinical implications of BIRC3 mutations in chronic lymphocytic leukemia. Haematologica 2020; 105(2): 448-56
[21] Thompson PA et al.: Fludarabine, cyclophosphamide, and rituximab treatment achieves longterm disease-free survival in IGHV-mutated chron ic lymphocytic leukemia. Blood 2016; 127: 303-9
[22] Burger JA et al.: Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia. N Engl J Med 2015; 373; 2425-37
[23] Burger JA et al.: Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia 2019; doi.org/10.1038/s41375-019-0602-x
[24] Moreno C et al.: Ibrutinib plus obinutuzumab versus chlorambucil plus obinutuzumab in first-line treatment of chronic lymphocytic leukaemia (iLLUMINATE): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019; 20: 43-56
[25] Fischer K et al.: Venetoclax and obinutuzumab in patients with CLL and coexisting conditions. N Engl J Med 2019; 380: 2225-36
[26] Woyach JA al.: Ibrutinib regimens versus chemoimmunotherapy in older patients with untreated CLL. N Engl J Med 2018; 379: 2517-28
[27] Shanafelt TD et al.: Ibrutinib-rituximab or chemoimmunotherapy for chronic lymphocytic leukemia. N Engl J Med 2019; 381: 432-43
[28] Shanafelt TD et al.: Ibrutinib and rituximab provides superior clinical outcome compared to FCR in younger patients with chronic lymphocytic leukemia (CLL): extended follow-up from the E1912 trial. ASH 2019, Abstract 33
[29] Robak T et al.: Rituximab plus fludarabine and cyclophosphamide prolongs progression-free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28: 1756-65
[30] Badoux XC et al.: Fludarabine, cyclophosphamide, and rituximab chemoimmunotherapy is highly effective treatment for relapsed patients with CLL. Blood 2011; 11: 3016-24
[31] Fischer K et al.: Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2011; 29: 3559-66
[32] Byrd J et al.: Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371: 213-23
[33] Munir T et al.: Final analysis from RESONATE: up to six years of follow-up on ibrutinib in patients with previously treated chron ic lymphocytic leukemia or small lymphocytic lymphoma. Am J Hematol 2019; 94: 1353-63
[34] Furman RR et al.: Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014; 370: 99-1007
[35] Seymour JF et al.: Venetoclax– rituximab in relapsed or refractory chronic lymphocytic leukemia. N Engl J Med 2018; 37: 1107-20
[36] Seymour JF et al.: Four-year analysis of Murano study confirms sustained benefit of timelimit ed venetoclax-rituximab in relapsed/refractory chronic lymphocytic leukemia. ASH 2019, Abstract 355
[37] Dreger P et al. for the European Research Initiative on CLL (ERIC) and the European Society for Blood and Marrow Transplantation (EBMT): High-risk chronic lymphocytic leukemia in the era of pathway inhibitors: integrating molecular and cellular therapies. Blood 2018; 132: 892-902
[38] Jain N et al.: Ibrutinib and venetoclax for firstline treatment of CLL. N Engl J Med 2019; 380: 2095-103
[39] Jain N et al.: Combined ibrutinib and venetoclax for first-line treatment for patients with chronic lymphocytic leukemia. ASH 2019, Abstract 34
[40] Jain N et al.: Combined ibrutinib and venetoclax in patients with relapsed/refractory chronic lymphocytic leukemia. ASH 2019, Abstract 359
[41] Rogers KA et al.: Phase 1b study of obinutuzumab, ibrutinib, and venetoclax in relapsed and refractory chronic lymphocytic leukemia. Blood 2018: 132: 1568-72
[42] Rogers KA et al.: Initial results of the phase 2 treatment naive cohort in a phase 1b/2 study of obinutuzumab, ibrutinib, and venetoclax in chronic lymphocytic leukemia. Blood 2017; 130(Suppl 1): Abstract 431
[43] Sharman JP et al.: Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzmab for treatmentnaive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet 2020; 395: 1278-91
[44] Finn IW et al.: The phase 3 DUO trial: duvelisib vs ofatumumab in relapsed and refractory CLL/SLL. Blood 2018; 132: 2446-55